Открытая система - термодинамич. система, к-рая обменивается с окружающей средой веществом, энергией и импульсом .К
наиб. важному типу О. с. относятся хим. системы, в к-рых непрерывно протекают
хим. реакции (извне поступают реагирующие вещества и отводятся продукты
реакций). Биол. системы (живые организмы) можно также рассматривать как
открытые хим. системы. Такой подход позволяет исследовать процессы их жизнедеятельности
и развития на основе термодинамики неравновесных процессов, физ.
и хим. кинетики.
Свойства О. с. описываются наиб. просто
вблизи состояния термодинамич. равновесия. Если отклонение О. с. от термодинамич.
равновесия мало, то неравновесное состояние можно охарактеризовать теми
же параметрами, что и равновесное: температурой, хим. потенциалами компонентов
системы и др. (но не с постоянными для всей системы значениями, а с зависящими
от координат и времени). Степень неупорядоченности таких О. с., как и систем
в равновесном состоянии, характеризуется энтропией. Энтропия О.
с. в неравновесном (локально-неравновесном) состоянии определяется, в силу
аддитивности энтропии, как сумма значений энтропии отд. малых элементов
системы, находящихся в локальном равновесии (см. Локальное термодинамическое
равновесие).
Отклонения термодинамич. параметров от
их равновесных значений (термодинамич. силы) вызывают в системе потоки
энергии вещества (см. Переноса явления ).Процессы переноса приводят
к росту энтропии системы (производству энтропии).
Согласно второму началу термодинамики, в
замкнутой изолиров. системе энтропия, возрастая, стремится к своему равновесному
макс. значению, а произ-во энтропии - к нулю. В отличие от замкнутой системы,
в О. с. возможны стационарные состоянии с пост. энтропиен при пост. произ-ве
энтропии, к-рая должна при этом отводиться от системы. Стационарное состояние
характеризуется постоянством скоростей хим. реакций и переноса реагирующих
веществ и энергии. При таком "проточном равновесии" произ-во энтропии в
О. с. минимально (Пригожина теорема ).Стационарное неравновесное
состояние играет в термодинамике О. с. такую же роль, какую играет термодинамич.
равновесие в термодинамике равновесных процессов. Энтропия О. с. в этом
состоянии хотя и поддерживается постоянной (произ-во энтропии компенсируется
её отводом), но это стационарное значение энтропии не соответствует её
максимуму (в отличие от замкнутой изолпров. системы).
Наиб. интересные свойства О. с. выявляются
при нелинейных процессах, когда в О. с. возможно осуществление термодинамически
устойчивых неравновесных (в частном случае стационарных) состояний, далёких
от состояния термодинамич. равновесия и характеризующихся определённой
пространственной или временной упорядоченностью (структурой), к-рую наз.
диссипативной, т. к. её существование требует непрерывного обмена веществом
и энергией с окружающей средой. Нелинейные процессы в О. с. и возможность
образования диссипативных структур исследуют на основе ур-ний хим.
кинетики: баланса скоростей хим. реакций в системе со скоростями подачи
реагирующих веществ и отвода продуктов реакций. Накопление в О. с. активных
продуктов реакций или теплоты может привести к автоколебательному (самоподдерживающемуся)
режиму реакций. Для этого необходимо, чтобы в системе реализовалась положительная
обратная
связь: ускорение реакции под воздействием либо её продукта (хим. автокатализ),
либо теплоты, выделяющейся при реакции. Подобно тому как в колебат. контуре
с положит. обратной связью возникают устойчивые саморегулирующиеся незатухающие
колебания (автоколебания ),в хим. О. с. с положит. обратной связью
возникают незатухающие саморегулирующиеся хим. реакции. Автокаталитич.
реакции могут привести к неустойчивости хим. процессов в однородной среде
и к появлению у О. с. стационарных состояний с упорядоченным в пространстве
неоднородным распределением концентраций. В О. с. возможны также копцентрац.
волны сложного нелинейного характера
(автоволны ).Теория О. с. представляет
особый интерес для понимания физ--хим. процессов, лежащих в основе жизни,
т. к. живой организм - это устойчивая саморегулирующаяся О. с., обладающая
высокой организацией как на молекулярном, так и на макроскопич. уровне.
Подход к живым системам как к О. с., в к-рых протекают нелинейные хим.
реакции, создаёт новые возможности для исследования процессов молекулярной
самоорганизации на ранних этапах появления жизни.
Примером О. с. может служить система с
четырьмя сортами молекул А, В, С, X, между к-рыми возможны две хим. реакции
по схемам
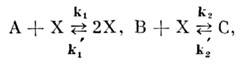
где стрелками обозначают прямую и обратную
реакции, k1, k2,
k'1,
k'2
- константы скоростей прямой и обратной реакций. Концентрации а, b,
с молекул А, В, С и константы скоростей реакций поддерживаются постоянными
за счёт подвода и отвода вещества и тепла, что характерно для О. с. На
практике, если кол-во веществ А, В, С велико по сравнению с кол-вом веществ
X, то их концентрации можно считать постоянными.
Концентрация п веществ X может
зависеть от времени t за счёт протекания хим. реакций. Из двух ур-ний
баланса веществ в реакциях (с учётом действующих масс закона)следует,
что
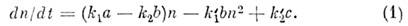
Из ур-ния (1) вытекает, что при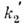 = 0 и k1а = k2b величина п при
любом нач. условии с ростом t стремится к нулю как
= 0 и k1а = k2b величина п при
любом нач. условии с ростом t стремится к нулю как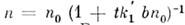 , где п0 - нач. значение концентрации п. В этом
же случае при k1a < k2b в пределе п также
стремится к нулю, но экспоненциально, а при k1a > k2b величина
п стремится к постоянному предельному значению, зависящему от соотношения
коэф. в (1):
, где п0 - нач. значение концентрации п. В этом
же случае при k1a < k2b в пределе п также
стремится к нулю, но экспоненциально, а при k1a > k2b величина
п стремится к постоянному предельному значению, зависящему от соотношения
коэф. в (1):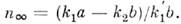 Наличие неск. предельных стационарных состояний является характерным свойством
О. с., связанным с тем, что они описываются нелинейными дифференц. ур-ниями.
Упрощённая модель одномодового лазера также описывается ур-нием типа (1)
для числа возбуждённых атомов п при
Наличие неск. предельных стационарных состояний является характерным свойством
О. с., связанным с тем, что они описываются нелинейными дифференц. ур-ниями.
Упрощённая модель одномодового лазера также описывается ур-нием типа (1)
для числа возбуждённых атомов п при =
0 с коэф., зависящими от коэф. усиления и затухания вследствие потерь в
лазере.
=
0 с коэф., зависящими от коэф. усиления и затухания вследствие потерь в
лазере.
Учёт явлений диффузии в ур-ниях
баланса хим. реакций приводит к дополнит. членам Dд2n/дx2
(D - коэф. диффузии, х - пространственная координата), откуда
следует, что в стационарных состояниях таких О. с. концентрации п(х)пространственно
неоднородны, кроме того, при определ. условиях в них могут существовать
области, где п(х)испытывает пространств. осцилляции (диссииативные
структуры).
Др. примером О. с. является экологич.
система "хищник - жертва", к-рая описывается ур-ниями Лотки - Вольтерры
(ур-ния баланса числа "жертв" п1 и "хищников"
n2):
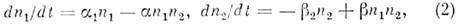
где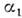 ,
,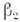 характеризуют скорости возрастания популяций "жертв" при отсутствии "хищников"
и убывания "хищников" при отсутствии "жертв". Коэф.
характеризуют скорости возрастания популяций "жертв" при отсутствии "хищников"
и убывания "хищников" при отсутствии "жертв". Коэф.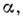
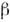 характеризуют скорости гибели "жертв" из-за наличия "хищников" и возрастания
"хищников" из-за наличия "жертв". Коэф. считаются постоянными, это означает,
в частности, что запасы пищи для "жертв" достаточно велики или восполняются.
Такая экологич. система имеет два положения равновесия пг=
п2
= 0 и
характеризуют скорости гибели "жертв" из-за наличия "хищников" и возрастания
"хищников" из-за наличия "жертв". Коэф. считаются постоянными, это означает,
в частности, что запасы пищи для "жертв" достаточно велики или восполняются.
Такая экологич. система имеет два положения равновесия пг=
п2
= 0 и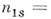
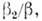
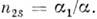 Относительные числа "жертв" и "хищников" и = n1/nls,
v
= n2/n2s удовлетворяют уравнению
Относительные числа "жертв" и "хищников" и = n1/nls,
v
= n2/n2s удовлетворяют уравнению
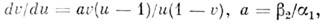
к-рое имеет решение
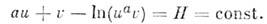
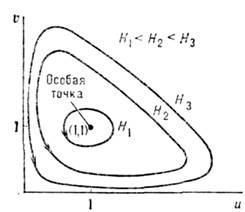
Ур-ния (2) имеют периодич. решения, к-рым
соответствуют предельные циклы, изображённые на фазовой плоскости (рис.).
Эти решения описывают периодич. колебания числа "жертв" и "хищников". Возможность
таких незатухающих нелинейных колебаний является важным свойством О. с.
Гидродинамич. системы в турбулентном состоянии
являются также примером О. с. В них возможны стационарные состояния с сильными
флуктуациями из-за баланса импульса с учётом его переноса, вызванного неоднородностями
флуктуации скоростей, и баланса флуктуации скоростей с учётом их релаксации
и диффузии.
Открытый характер системы связан с тем,
что градиент давления, обусловливающий турбулентный поток, и темп-pa поддерживаются
постоянными.
Теория О. с. - одно из направлений общей
теории систем, к к-рым относятся, напр., рассматриваемые в кибернетике
системы переработки информации, транспортные узлы, системы энергоснабжения
и др. Подобные системы, хотя и не являются термодинамическими, описываются
системой ур-ний баланса, в общем случае нелинейных и сходных с аналогичными
ур-ниями для физ--хим. и биол. О. с. Для всех подобных систем существуют
общие проблемы регулирования и оптим. функционирования.

Д. Н. Зубарев
Когда тот или иной физик использует понятие "физический вакуум", он либо не понимает абсурдности этого термина, либо лукавит, являясь скрытым или явным приверженцем релятивистской идеологии.
Понять абсурдность этого понятия легче всего обратившись к истокам его возникновения. Рождено оно было Полем Дираком в 1930-х, когда стало ясно, что отрицание эфира в чистом виде, как это делал великий математик, но посредственный физик Анри Пуанкаре, уже нельзя. Слишком много фактов противоречит этому.
Для защиты релятивизма Поль Дирак ввел афизическое и алогичное понятие отрицательной энергии, а затем и существование "моря" двух компенсирующих друг друга энергий в вакууме - положительной и отрицательной, а также "моря" компенсирующих друг друга частиц - виртуальных (то есть кажущихся) электронов и позитронов в вакууме.
Однако такая постановка является внутренне противоречивой (виртуальные частицы ненаблюдаемы и их по произволу можно считать в одном случае отсутствующими, а в другом - присутствующими) и противоречащей релятивизму (то есть отрицанию эфира, так как при наличии таких частиц в вакууме релятивизм уже просто невозможен). Подробнее читайте в FAQ по эфирной физике.
|
|