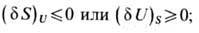
Химическая термодинамика - раздел термодинамики, изучающий хим. и физ--хим. процессы в разл. фазах вещества. Химическая термодинамика включает теорию хим. равновесия, хим. превращений и фазовых переходов в системах при наличии в них хим. реакций.
Теоретич. фундаментом химической термодинамики является метод Гиббса, к-рый позволяет формулировать условия равновесия термодинамического в наиб. общей и удобной для применения форме (до разработки этого метода для каждой конкретной задачи приходилось строить вспомогат. обратимый цикл). Согласно Дж. У. Гиббсу (J. W. Gibbs), для равновесия любой термодинамич. системы необходимо и достаточно, чтобы вариация энтропии dS была не положительна при фиксированной внутр. энергии U или чтобы была не отрицательна вариация внутр. энергии dU при фиксированном значении энтропии S, т. е. при
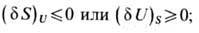
знаки "меньше" или "больше" соответствуют устойчивому равновесию, а знаки равенства - безразличному (лабильному) равновесию. Вариация энтропии характерна для спе-цифич. термич. возмущений, а второй критерий равновесия [(dU)s>=0] аналогичен условию равновесия механич. системы (см. Возможных перемещений принцип), причём внутр. энергия U при этом аналогична потенц. энергии механич. системы и имеет экстремальное значение при дополнит. условии постоянства энтропии и полного объёма системы V.
Для формулировки задачи о равновесии гетерогенных и многокомпонентных термодинамич. систем Гиббс ввёл понятие фазы, т.е. совокупности гомогенных (однородных) частей гетерогенной (неоднородной) системы, одинаковых по всем физ. и хим. свойствам независимо от кол-ва вещества и существования или отсутствия разделяющих поверхностей между отд. фазами. Фаза может быть охарактеризована её энтропией или внутр. энергией, зависящими лишь от свойств и состояния фазы. Вещества, из к-рых состоит система, являются её независимыми составными частями - компонентами, к-рые могут обратимо переходить из одной фазы в другую.
Внутр. энергия каждой фазы
может меняться не только за счёт изменения её энтропии S и объёма V, но и за счёт изменения числа молей ni её компонентов.
Согласно 2-му началу термодинамики,
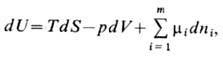
где р-давление, mi-химический потенциал, т - число компонентов. Это ур-ние наз. фундаментальным уравнением Гиббса. Из него следует, что
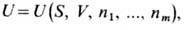
а хим. потенциал mi
= (дU/дni)S,V в предположении, что все параметры,
кроме ni, постоянны; физ. смысл хим. потенциала- работа по
перенесению вещества, к-рую нужно совершить, чтобы увеличить массу данного компонента
в фазе на единицу при условии постоянства её энтропии, объёма, а также масс
всех остальных её компонент. Фун-дам. ур-ние имеет место для каждой фазы системы,
совокупность этих ур-ний полностью определяет термодинамич. состояние системы.
Параметры состояния Т, р, ..., mi, ... являются интенсивными, не зависящими
друг от друга и связанными Гиббса- Дюгема уравнением:
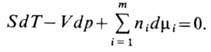
Применяя общий критерий равновесия при дополнит. условиях постоянства энтропии, объёма и массы каждого
из компонентов, получим условие полного равновесия гетерогенной системы: равенство
во всех фазах системы температуры, давления и хим. потенциалов для каждого компонента.
Если хим. потенциалы не равны, то вещество стремится перейти в фазу с наинизшим
хим. потенциалом; т. о., хим. потенциал играет такую же роль для равновесия
фаз, как и темп-pa для теплового равновесия термодинамич. системы.
Если число независимых переменных в ур-ниях Гиббса - Дюгема для равновесной системы не превышает числа
этих ур-ний, то выполняется Гиббса правило фаз: число фаз, существующих
в равновесии, не может превосходить число независимых компонентов более чем
на два. Макс. число сосуществующих фаз достигается при равенстве числа переменных
числу ур-ний. Правило фаз Гиббса определяет число независимых переменных, к-рые
можно изменять, не нарушая равновесия (число термодинамических степеней свободы). Для выполнения правила фаз Гиббса необходимо, чтобы каждая фаза была однородна
во всём своём объёме, их размеры были достаточными, чтобы поверхностными натяжениями
можно было бы пренебречь, а каждый компонент мог беспрепятственно проходить
через поверхность раздела фаз, т. е. в системе должны отсутствовать полупроницаемые
перегородки. Правило фаз Гиббса является основой физ--хим. анализа сложных систем
и классификации разл. случаев хим. равновесия.
Термодинамич. равновесие систем, в к-рых возможны хим. реакции, также описывается с помощью метода Гиббса,
если в качестве ур-ний связи при экстремуме к--л. из термодинамич. потенциалов
учесть дополнительно ур-ния баланса вещества при хим. реакции (ур-ния хим. реакции).
Напр., при хим. реакции
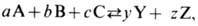
где а, b, с, у, z-целые числа, А, В, С, Y, Z-символы хим. веществ, в состоянии термодинамич. равновесия должно быть выполнено условие
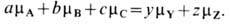
Если хим. реакцию записать в общем виде:
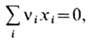
то условия равновесия принимают вид
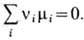
Для хим. реакции в газе
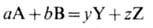
из условия равновесия следует
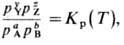
где рyY,рzZ,paA,pbB - парциальные давления соответственно конечных и исходных продуктов реакции; Кр - константа химического равновесия, зависящая только от температуры. Для неё имеет место уравнение Вант-Гоффа:

где DH0
- изменение энтальпии в реакции.
Для гомогенных хим. реакций в жидкой фазе можно использовать ур-ния для газовой фазы, если ввести т.н. коэффициенты
активности (см. Фугитивность)компонентов:
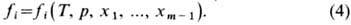
Для идеального газа коэф.
активности равен 1. Введение коэф. активности, характеризующих отклонение реального
газа от идеального, даёт возможность проводить термоди-намич. расчёты хим. реакций
с использованием эксперим. данных для термодинамических потенциалов.
Применяя метод Гиббса в теории диссоциации, В. Нернст (W. Nernst) вывел закон распределения концентраций
для диссоциированных веществ. Исходя из теории хим. равновесия, он установил
теорему об универсальном поведении энтропии при стремлении температуры к абс. нулю
(см. Третье начало термодинамики).
Критерий равновесия Гиббса как экстремум соответствующего термодинамич. потенциала ещё недостаточен для
того, чтобы сделать заключение об устойчивости соответствующего состояния. Из
общего критерия равновесия Гиббса следует, что для этого требуется знание поведения
вторых вариаций термодинамич. потенциалов.
Условие устойчивости системы в энергетическом выражении для гомогенной системы можно представить в виде неравенства
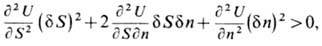
что возможно тогда и только тогда, когда определитель и гл. миноры матрицы
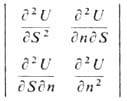
положительны. Отсюда следуют условия термич. и меха-нич. устойчивости системы:
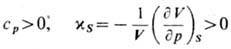
(ср
- теплоёмкость при пост. давлении р, 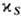 -адиабатич.
сжимаемость). Из условий устойчивости следует Ле Шате-лье - Брауна принцип: система, находящаяся в равновесии, реагирует на внеш. воздействие т. о.,
чтобы уменьшить это воздействие.
-адиабатич.
сжимаемость). Из условий устойчивости следует Ле Шате-лье - Брауна принцип: система, находящаяся в равновесии, реагирует на внеш. воздействие т. о.,
чтобы уменьшить это воздействие.
Условие устойчивости хим. реакции можно получить, если ввести вместо ni новую переменную:
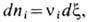
где x- число пробегов реакции. Тогда необходимое и достаточное условие стабильности системы примет вид неравенства
для энергии Гиббса DG:
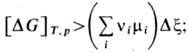
из этого неравенства можно получить и др. критерии устойчивости термодинамич. системы.
Две сосуществующие фазы при изменении параметров состояния приходят в равновесие. Однокомпонентные системы
жидкость - пар имеют одну критич. точку, выше к-рой невозможно сконденсировать
пар (см. рис. в ст. Кипение ).Кривые, на к-рых расположены сосуществующие
фазы жидкости и пара, наз. кривыми сосуществования, или бинодалями.
На каждой изотерме р(V)между минимумом и максимумом расположены нестабильные
состояния; кривая, соединяющая минимумы и максимумы и ограничивающая нестабильную
область, наз. спинодалью. Область между спинодалью и бинодалью соответствует
только метастабильным состояниям, т. е. перегретой жидкости или пересыщенному
пару.
В эл--хим. системах (водных
растворах электролитов, расплавах солей) при отсутствии разности электрич. потенциала
имеет место условие нейтральности:
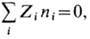
где Zi
- валентности ионов, сумма берётся по всем i видам ионов. Чтобы сформулировать
условия электрохим. равновесия гетерогенной эл--хим. системы, нужно в ур-нии
Гиббса учесть полную вариацию внутр. энергии:
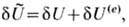
где 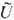 -полная
внутр. энергия, U(e)-её электрич. часть, вариация к-рой
-полная
внутр. энергия, U(e)-её электрич. часть, вариация к-рой
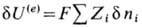
(F-Фарадея постоянная, равная заряду одного моля одновалентных ионов, F= 96487 К/моль).
Обобщённое фун-дам. ур-ние принимает вид

где 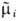 =mi
+ ZiFj - эл--хим. потенциал, j-электрич. потенциал. Это ур-ние
вместе с дополнит. условиями позволяет исследовать все термодинамич. свойства
эл--хим. систем.
=mi
+ ZiFj - эл--хим. потенциал, j-электрич. потенциал. Это ур-ние
вместе с дополнит. условиями позволяет исследовать все термодинамич. свойства
эл--хим. систем.
К X. т. относится также неравновесная термодинамика с хим. реакциями.

|
|