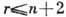 . Г. п. ф. установлено Дж. У. Гиббсом в 1875.
. Г. п. ф. установлено Дж. У. Гиббсом в 1875.Гиббса правило фаз - закон термодинамики многофазных многокомпонентных систем, согласно к-рому число
фаз г, сосуществующих в равновесии, не превосходит числа независимых компонентов
п более чем на два: 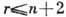 . Г. п. ф. установлено Дж. У. Гиббсом в 1875.
. Г. п. ф. установлено Дж. У. Гиббсом в 1875.
В основе Г. п. ф. лежит
предположение, что каждой фазе соответствует свой термодинамический потенциал (напр., энергия Гиббса) как функция независимых термодинамич. параметров.
Фазу можно определить как однородную совокупность масс, термодинамич. свойства
к-рых одинаково связаны с параметрами состояния. Г. п. ф. есть следствие условий
термодинамич. равновесия многокомпонентных многофазных систем, т. к. число независимых
термодинамич. переменных в равновесии не должно превышать числа ур-ний для них.
Макс. число сосуществующих фаз достигается, когда число переменных равно числу
ур-ний, определяющих термодинамич. равновесие. Г. п. ф. задаёт число независимых
переменных, к-рые можно изменить, не нарушая равновесия, т. е. число термодинамич.
степеней свободы системы:  . Число f наз. числом степеней свободы или вариантностью термодинамич.
системы. При f=0 система наз. ин(нон)вариантной, при f=1 - моно(уни)вариантной,
при f=2 - ди(би)вариантной, при
. Число f наз. числом степеней свободы или вариантностью термодинамич.
системы. При f=0 система наз. ин(нон)вариантной, при f=1 - моно(уни)вариантной,
при f=2 - ди(би)вариантной, при 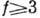 - поливариантной. Г. п. ф. справедливо, если фазы однородны во всём объёме и
имеют достаточно большие размеры, так что можно пренебречь поверхностными явлениями,
и если каждый компонент может беспрепятственно проходить через поверхности раздела
фаз, т. е. отсутствуют полупроницаемые перегородки. Цифра 2 в Г. п. ф. связана
с существованием 2 переменных (температуры и давления), одинаковых для всех фаз.
Если на систему действуют внеш. силы (напр., электрич. или магн. поле), то число
степеней свободы возрастает на число независимых внеш. сил. При рассмотрении
фазового равновесия в системах с дисперсной жидкой фазой необходимо учитывать
силы поверхностного натяжения. В этом случае число степеней свободы возрастает
на единицу и Г. п. ф. выражается соотношением
- поливариантной. Г. п. ф. справедливо, если фазы однородны во всём объёме и
имеют достаточно большие размеры, так что можно пренебречь поверхностными явлениями,
и если каждый компонент может беспрепятственно проходить через поверхности раздела
фаз, т. е. отсутствуют полупроницаемые перегородки. Цифра 2 в Г. п. ф. связана
с существованием 2 переменных (температуры и давления), одинаковых для всех фаз.
Если на систему действуют внеш. силы (напр., электрич. или магн. поле), то число
степеней свободы возрастает на число независимых внеш. сил. При рассмотрении
фазового равновесия в системах с дисперсной жидкой фазой необходимо учитывать
силы поверхностного натяжения. В этом случае число степеней свободы возрастает
на единицу и Г. п. ф. выражается соотношением 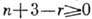 .
.
Если в системе не происходит
хим. превращений, то число независимых компонентов равно числу простых веществ,
из к-рых состоит смесь. Если в системе возможны хим. взаимодействия, то условия
равновесия включают, помимо обычных условий равновесия фаз, ур-ния хим. реакций.
Число дополнит. условий равно числу независимых реакций, протекающих в системе.
Ур-ние баланса хим. реакции налагает ограничения на изменение параметров состояния,
сокращая на единицу число независимых переменных. Если в системе, состоящей
из n веществ и r фаз, протекает k независимых реакций,
то число независимо изменяющихся параметров состояния равно f=n-
k-r+2.
Г. п. ф. является основой
физ--хим. анализа сложных систем, его использовали для классификации разл. случаев
хим. равновесия. При помощи Г. п. ф. были открыты новые вещества и определены
условия, при к-рых они могут существовать.

Д. H. Зубарев
Когда тот или иной физик использует понятие "физический вакуум", он либо не понимает абсурдности этого термина, либо лукавит, являясь скрытым или явным приверженцем релятивистской идеологии.
Понять абсурдность этого понятия легче всего обратившись к истокам его возникновения. Рождено оно было Полем Дираком в 1930-х, когда стало ясно, что отрицание эфира в чистом виде, как это делал великий математик, но посредственный физик Анри Пуанкаре, уже нельзя. Слишком много фактов противоречит этому.
Для защиты релятивизма Поль Дирак ввел афизическое и алогичное понятие отрицательной энергии, а затем и существование "моря" двух компенсирующих друг друга энергий в вакууме - положительной и отрицательной, а также "моря" компенсирующих друг друга частиц - виртуальных (то есть кажущихся) электронов и позитронов в вакууме.
Однако такая постановка является внутренне противоречивой (виртуальные частицы ненаблюдаемы и их по произволу можно считать в одном случае отсутствующими, а в другом - присутствующими) и противоречащей релятивизму (то есть отрицанию эфира, так как при наличии таких частиц в вакууме релятивизм уже просто невозможен). Подробнее читайте в FAQ по эфирной физике.
|
|