Гиббса - Дюгема уравнение - термодинамич. соотношение между приращениями температуры T, давления P и хим. потенциалов 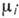 многокомпонентной термодинамич. системы:
многокомпонентной термодинамич. системы: 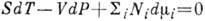 ,
где S - энтропия, V - объём, Ni - число частиц
i-го компонента. Для многофазной системы i учитывает также разл.
фазы. Вместо Ni можно брать массы компонент и нормировать
хим. потенциал
,
где S - энтропия, V - объём, Ni - число частиц
i-го компонента. Для многофазной системы i учитывает также разл.
фазы. Вместо Ni можно брать массы компонент и нормировать
хим. потенциал 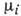 на единицу массы. Получено Дж. У. Гиббсом в 1875 и широко применялось П. Дюгемом
(Дюэмом) (P. Duhem). Г. - Д. у. устанавливает связь между интенсивными термодинамич.
параметрами, к-рые при термодинамич. равновесии постоянны. Оно следует из того,
что, согласно второму началу термодинамики, приращение Гиббса энергии G равно
на единицу массы. Получено Дж. У. Гиббсом в 1875 и широко применялось П. Дюгемом
(Дюэмом) (P. Duhem). Г. - Д. у. устанавливает связь между интенсивными термодинамич.
параметрами, к-рые при термодинамич. равновесии постоянны. Оно следует из того,
что, согласно второму началу термодинамики, приращение Гиббса энергии G равно
Д. H. Зубарев
Знаете ли Вы, что в 1965 году два американца Пензиас (эмигрант из Германии) и Вильсон заявили, что они открыли излучение космоса. Через несколько лет им дали Нобелевскую премию, как-будто никто не знал работ
Э. Регенера, измерившего температуру космического пространства с помощью запуска болометра в стратосферу в 1933 г.? Подробнее читайте в
FAQ по эфирной физике.
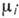 многокомпонентной термодинамич. системы:
многокомпонентной термодинамич. системы: 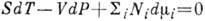 ,
где S - энтропия, V - объём, Ni - число частиц
i-го компонента. Для многофазной системы i учитывает также разл.
фазы. Вместо Ni можно брать массы компонент и нормировать
хим. потенциал
,
где S - энтропия, V - объём, Ni - число частиц
i-го компонента. Для многофазной системы i учитывает также разл.
фазы. Вместо Ni можно брать массы компонент и нормировать
хим. потенциал 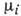 на единицу массы. Получено Дж. У. Гиббсом в 1875 и широко применялось П. Дюгемом
(Дюэмом) (P. Duhem). Г. - Д. у. устанавливает связь между интенсивными термодинамич.
параметрами, к-рые при термодинамич. равновесии постоянны. Оно следует из того,
что, согласно второму началу термодинамики, приращение Гиббса энергии G равно
на единицу массы. Получено Дж. У. Гиббсом в 1875 и широко применялось П. Дюгемом
(Дюэмом) (P. Duhem). Г. - Д. у. устанавливает связь между интенсивными термодинамич.
параметрами, к-рые при термодинамич. равновесии постоянны. Оно следует из того,
что, согласно второму началу термодинамики, приращение Гиббса энергии G равно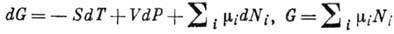 .
.
