Кристаллохимия - раздел кристаллографии, в к-ром изучаются закономерности расположения атомов
в кристаллах и природа хим. связи между ними. К. основана на обобщении результатов
экспериментальных рентгенографич. и др. дифракц. методов исследований атомной
структуры кристаллов (см. Кристаллическая структура, Рентгеновский структурный
анализ, Электронография, Нейтронография), на классических и квантовых теориях
хим. связи, на расчётах энергии кристаллич. структур с учётом симметрии кристаллов.
Кристаллохим. закономерности позволяют объяснить и в ряде случаев предсказать,
исходя из хим. состава вещества, расположение атомов или молекул в кристаллич.
структуре и расстояния между ними.
Хим. связь между атомами
в кристаллах возникает за счёт взаимодействия внеш. валентных электронов атомов,
тогда как внутренние электронные оболочки практически остаются неизменными.
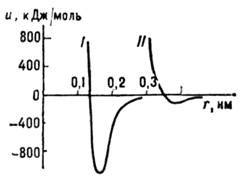
На рис. 1 показаны типичные кривые потенц. энергии и(r)межатомного взаимодействия.
Равновесное расстояние rр между атомами обычно составляет
0,15-0,40 нм (в зависимости от типа хим. связи). При сближении атомов на расстояния
меньшие, чем равновесное, возникает резкое их отталкивание. Это позволяет в
первом приближении приписать атомам для того или иного типа связи определ. "размеры",
т. е. нек-рые пост. радиусы, и тем самым перейти от физ. модели кристалла как
атомноэлектронной системы к его геом. модели как системе несжимающихся
шариков. Полное кристаллохим. описание атомной структуры того или иного кристалла
включает указание размеров элементарной ячейки, пространственной группы симметрии кристалла, координат атомов, расстояний между ними, типа хим. связи; описания
окружения атомов, характерных атомных группировок, тепловых колебаний атомов
и т. п. По характеру хим. связи кристаллы делятся на четыре осн. группы - ионные
кристаллы (напр., NaCl), ковалентные (напр., алмаз, кремний), металлические
(металлы и интерметаллические
соединения)и молекулярные кристаллы (напр., нафталин).

Рис. 1. Кривые энергии
межатомного взаимодействия: I-для сильной (ионной, ковалентной, металлической)
связи, II -для слабой (ван-дер-ваальсовой) связи.
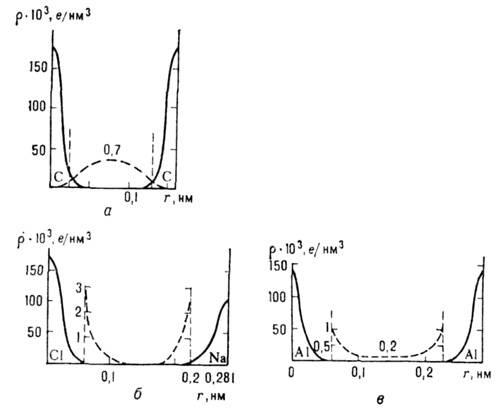
Рис. 2. Распределение электронной плотности на линии связи между атомами в кристаллах: а- ковалент-ная связь (алмаз С), пунктирная линия - электронная плотность валентной пары электронов; б - ионная связь (NaCl), пунктирная линия - область внешних электронных орбит; в - металлическая связь (А1), пунктирная линия - плотность электронов в межатомном пространстве.
В ионных кристаллах внешние
валентные электроны переходят от атомов металлов, к-рые становятся положит.
ионами (катионами), к атомам неметаллов, к-рые становятся отрицат. ионами (анионами),
что приводит к электростатич. притяжению между ними (рис. 1). Ионизация атомов
в ионных кристаллах не точно соответствует их формальному заряду, напр. в NaCl
эффективный заряд  в Na+ составляет +0,8е, а в С1
в Na+ составляет +0,8е, а в С1  =
-0,8 е, в силикатах эфф. заряд Si4+
=
-0,8 е, в силикатах эфф. заряд Si4+ 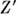 =(1-2)e, a кислорода О2 -
=(1-2)e, a кислорода О2 - 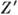 =
-(0,9-1,1)е. Взаимодействие ионов является кулоновским, но при их соприкосновении
начинают играть роль силы отталкивания между электронными оболочками; потенц.
энергия их взаимодействия описывается ф-лой
=
-(0,9-1,1)е. Взаимодействие ионов является кулоновским, но при их соприкосновении
начинают играть роль силы отталкивания между электронными оболочками; потенц.
энергия их взаимодействия описывается ф-лой
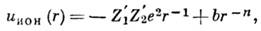
где r - расстояние
между центрами ионов; Ь и п - параметры, к-рые могут быть найдены
из сжимаемости кристаллов;
n=(6-9). В межатомном пространстве в ионных кристаллах электронная плотность
r (r)близка к нулю (рис. 2, б).
В случае ковалентной связи
пары валентных электронов соседних атомов обобществляются, образуя "мостики"
электронной плотности между связанными атомами (рис. 2, а). Силы взаимодействия
между атомами являются направленными и имеют квантовомеханич. природу
(см. Обменное взаимодействие ).Потенц. энергия взаимодействия феноменологически
записывается в виде
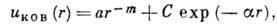
где m=4, а,  ,
С - константы, более точно uков получают из решения методами
квантовой химии ур-ния Шрёдингера.
,
С - константы, более точно uков получают из решения методами
квантовой химии ур-ния Шрёдингера.
Природа металлич. связи
та же, что и ковалентной, т. е. обобществление внешних валентных электронов
атомов, однако характер локализации этих электронов иной - они приблизительно
равномерно заполняют всё межатомное пространство, образуя общий электронный
"газ", к-рый и осуществляет коллективное взаимодействие с заряженными
положительно атомами металла (рис. 2, в). Особый случай - т. н. электронные
соединения (фазы Юм - Розери). Расстояние между атомами для трёх осн. типов
сильной связи в кристаллах неорганич. соединений - ионной, ковалентной, металлической
- составляет 0,15-0,25 нм, оно тем больше, чем больше электронов в атомах, образующих
связь (т. с. чем больше их атомные номера Z).
В молекулярных кристаллах атомы внутри молекул объединены прочными ковалентными связями, а атомы соседних
молекул взаимодействуют за счёт более слабых ван-дер-ваальсовых сил, имеющих
дипольное и дисперсионное происхождение (см. Межмолекулярное взаимодействие). Расстояние между атомами соседних молекул 0,35-0,4 нм. Во многих кристаллах
связь имеет промежуточный характер, напр. в кристаллах силикатов она ионно-ковалентная,
у полупроводников (Ge, Ga, As) связь в осн. ковалентная, но с примесью
ионной и металлической. В нек-рых кристаллах (напр., лёд, органич. кристаллы)
существует т. н. водородная связь (см. Межатомное взаимодействие).
Каждому кристаллич. веществу
присуща определ. кристаллич. структура, но при изменении термодинамич. условий
она иногда может меняться (полиморфизм ).Обычно чем проще ф-ла соединения,
тем более симметрична его структура. Кристаллы со сходной хим. ф-лой (в смысле
числа и соотношения разл. атомов) могут иметь одинаковую кристаллич. структуру,
несмотря на различие типов связи (т. н. изоструктурность); напр.: изоструктурны
галогениды щелочных металлов типа NaCl и нек-рые окислы (напр., MgO), ряд сплавов
(напр., Ti-Ni). Существуют большие серии изоструктурных соединений с ф-лами
вида АВ2, АВ3, АВХ3 и т. п. Изоструктурны кристаллы
мн. элементов, напр. кристаллы  -Fe
и Сu, образующие гранецентриров. кубич. решётку, но такую же структуру имеют
и отвердевшие инертные газы. Если кристаллы изоструктурны и обладают одинаковым
типом связи, их наз. изоморфными (см. Изоморфизм ).Во мн. случаях между
изоморфными кристаллами возможно образование непрерывного ряда твёрдых растворов.
-Fe
и Сu, образующие гранецентриров. кубич. решётку, но такую же структуру имеют
и отвердевшие инертные газы. Если кристаллы изоструктурны и обладают одинаковым
типом связи, их наз. изоморфными (см. Изоморфизм ).Во мн. случаях между
изоморфными кристаллами возможно образование непрерывного ряда твёрдых растворов.
В геом. модели кристаллич.
структуры К. использует концепцию эфф. радиусов атомов, ионов и молекул (кристаллохим.
радиусы): расстояния между ближайшими атомами в кристаллич. структурах равны
сумме радиусов (свойство аддитивности кристаллохим. радиусов). Атомные радиусы
rат в структурах простых веществ (элементов) с металлич. или
ковалентной связью равны половине кратчайшего межатомного расстояния. Межатомные
расстояния в структурах соединений с тем же типом связи хорошо описываются суммой
атомных радиусов. Напр., наблюдаемое расстояние Si-С в карбиде кремния (0,189
нм) практически совпадает с суммой указанных радиусов rат
(Si)=0,117 нм, rат(С) =0,077 нм, равной 0,194 нм.
Аналогично системе атомных
радиусов для ионных соединений вводят систему ионных радиусов rи.
В классич. системе "эффективных" ионных радиусов они выбраны так,
что радиусы катионов меньше радиусов анионов [напр., rи (Na+)=0,098
нм, rи (С1-)=0,181 нм], к ним близки "физические"
ионные радиусы, к-рые выбираются
по положению минимума электронной плотности между атомами.
Существует универсальная
система атомно-ионных (для всех типов сильной связи) радиусов rаи
атомов в кристаллах [в ней, напр., rаи(С)=0,070 нм, raи(Na)=0,180нм,
rаи(С1)=0,100 нм], к-рые фактически соответствуют радиусам
внешних электронных оболочек атомов. Система радиусов при слабой ван-дер-ваальсовой
связи описывает касания атомов соседних молекул в органич. кристаллах, где,
напр., rм(С)=0,170 нм, rм(С1)=0,178 нм (рис.
3). На основе экспериментальных данных построены таблицы кристаллохим. радиусов
для всех типов связей.
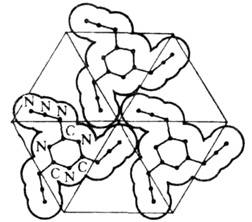
Рис. 3. Упаковка молекул три-азидциануровой кислоты в кристалле.
Одним из важнейших геом.
представлений в К. является теория плотной упаковки, к-рая наглядно объясняет
расположение атомов в ряде металлических (рис. 4) и ионных структур. В последнем
случае используется представление о заселении "пустот" в упаковке
анионов катионами, имеющими меньший ионный радиус. Тогда ионные структуры можно
представить как систему полиэдров - координац. многогранников, в центрах к-рых
находятся катионы, а атомы анионов - это их вершины (рис. 5); полиэдры "сцеплены"
рёбрами или вершинами. Координационное число К и вид координац. многогранника
характеризуют хим. связь данного атома и структуры кристалла в целом. Напр.,
Be (за редким исключением) и Ge имеют тетраэдрич. окружение (K=4), у
А1 и Сr координац. многогранник - октаэдр (К=6). Малые координац.
числа указывают на значит. роль направленной ковалентной связи, большие - на
большую роль ионной или металлич. связей. Во мн. кристаллич. структурах (графит,
MoS2 и др.) сосуществуют связи разл. типов. Такие структуры наз.
гетеродесмическими, в отличие от гомодесмических - с однотипной связью (алмаз,
металлы, NaCl, кристаллы инертных элементов). Для гетеродесмич. структур характерно
наличие обособленных структурных группировок-фрагментов, внутри к-рых атомы
соединены более прочными (обычно ковалентными) связями.
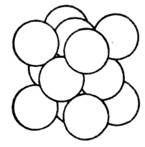
Рис. 4. Плотная упаковка
атомов в кристаллической структуре Сu.
Всё многообразие кристаллич. структур в К. классифицируют по хим. признакам и структурным особенностям укладки атомов. Кристаллические структуры простых веществ (элементов) определяются их положением в периодической системе элементов Менделеева. Их разделяют на две большие группы - металлов и неметаллов. Строение типичных металлов определяется ненаправленным характером металлич. связи, в соответствии с чем они представляют собой плотнейшие упаковки атомов (Li, Сu, К, Аu и др.). Далее в периодич. системе можно (продвигаясь по ней вправо и вниз) выделить ковалентные и ковалентно-металлич. структуры (Zn, Cd, Sn и др.), гетеродесмические молекулярные структуры (S, As, Se и др.) и структуры инертных элементов (Не-Хе), атомы к-рых упакованы плотно за счёт слабых ван-дер-ваальсовых связей.
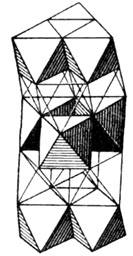
Рис. 5. Полиэдрическая структура
СdI2: в центрах полиэдров атомы Cd, в вершинах - атомы I.
Интерметаллич. структуры
(напр., Cu3Au, Mg2Sn, Сr2А1 и др.) имеют в
осн. металлич. характер связи. Громадное число неорганич. структур в К. относят
к ионным - это окислы, галогениды, мн. халькогениды, силикаты, в одних из них
связь имеет чисто ионный характер (напр., в NaCl, MgO, CaF2), в других
- ионно-ковалентный (кварц Si02 и др. силикаты). В ионных структурными
единицами могут служить сложные анионы типа СО32- (треугольник),
S02-4 (тетраэдр) и др. Для нек-рых классов ионных соединений
характерно наличие устойчивых структурных группировок, сочетающихся в них по-разному.
Так, в силикатах осн. структурный элемент - тетраэдрич. группировка Si04
может выступать либо изолированно, либо образовывать пары, кольца, цепочки,
слои и т. д. "Каркасные" структуры с пространственной вязью из тетраэдров
Si04 имеют большие полости.
Соединения с ковалентной
связью образуются чаще всего из элементов IV и близких к ней групп периодич.
системы, имеют небольшие координац. числа. Комплексные соединения образуются
островами на основе направленных связей металлов комплексообразователей (напр.,
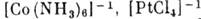 ).
).
Большой раздел составляет
К. органич. соединения. В нём рассматриваются правила плотной упаковки молекул,
связь симметрии молекул и симметрии кристалла, типы органич. структур. Большинство
органич. кристаллов построены из одного сорта молекул - гомо-молекулярных структур
(напр., нафталин), но существуют и кристаллы гетеромолекулярные, в к-рые в простых
рациональных отношениях (1:1, 1:2) входят разл. молекулы. Важным классом органич.
кристаллов являются хиральные, т. е. построенные только из правых или только
из левых энантиомеров молекул (см. Энантиоморфизм ),к к-рым принадлежат,
в частности, основные малые молекулы живых систем - аминокислоты, сахара и др.
Особые кристаллохим. закономерности выявляются в структуре полимерных кристаллов
(цепочечные структуры), жидких кристаллов, биологических кристаллов.
Образование той или иной кристаллич. структуры определяется общим принципом термодинамики: наиб. устойчива структура, к-рая при данном давлении и данной температуре Т имеет мин. свободную энергию W=U-ST, где U - энергия связи кристалла (энергия, необходимая для разъединения кристалла на отд. атомы или молекулы) при Т=0К, S - энтропия .Свободная энергия тем выше, чем сильнее связь в кристаллах. Она составляет 400-80 кДж/моль для кристаллов с ковалентной связью, несколько меньше у ионных и металлич. кристаллов и наиб. низка для молекулярных кристаллов с ван-дер-ваальсовыми связями (4-40 кДж/моль). Теоретич. определение свободной энергии и предсказание структуры пока возможны лишь для сравнительно простых случаев. Они проводятся в рамках зонной теории твёрдого тела. В ряде случаев достаточно точные результаты даёт использование полуэмпирич. выражений для потенц. энергии взаимодействия атомов в кристаллах с тем или иным типом связи. Материал, накопленный К., позволяет хорошо классифицировать и интерпретировать вновь определяемые структуры кристаллов, в простейших случаях предсказывать структуру и многие физ. и физ--хим. свойства.

Б. К. Вайнштейн
|
|