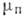 и
и 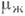 для пара и жидкости соответственно:
для пара и жидкости соответственно:Конденсация (от позднелат. condensatio - уплотнение, сгущение) - переход вещества из газообразного
состояния (пара) в жидкое или твёрдое состояние. Ква-зистатич. процесс К. происходит
в условиях равновесия сосуществующих фаз и является фазовым переходом 1-го рода.
Если при этом давление р поддерживается постоянным, то сохраняется постоянной
и абс. температура Т. Связь между р и Т определяется равенством химических
потенциалов 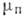 и
и 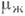 для пара и жидкости соответственно:
для пара и жидкости соответственно:

или задаётся Клапейрона
- Клаузиуса уравнением. Эти ур-ния справедливы как для К., так и для обратного
процесса - испарения, направление же процесса определяется теплообменом с окружающей
средой: если системе сообщается теплота, происходит испарение, при её отводе
- К. Кол-во теплоты, выделяющееся при К. единицы массы, равно теплоте испарения.
В квази-статич. условиях К. пара в жидкость возможна в интервале давления от
критического до давления в тройной, точке. Ниже давления в тройной точке
конденсирующийся пар граничит с кристаллом (рис. к ст. Испарение).
Равновесие между паром
и конденсированной фазой (напр., в замкнутом объёме) имеет динамич. характер:
ср. потоки конденсирующихся и испаряющихся молекул равны между собой, т. е.
компенсируют друг друга. При нарушении фазового равновесия величину нескомпенсированного
потока молекул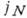 можно оценить, используя приближение идеального газа для пара (т. н. ур-ние
Герца - Кнудсена):
можно оценить, используя приближение идеального газа для пара (т. н. ур-ние
Герца - Кнудсена):
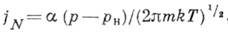
где 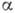 - коэф. конденсации, различный для разных веществ, рн - равновесное
давление (давление насыщения при температуре Т), т - масса молекулы. Если
в газовой фазе присутствует
неконденсирующий газ, то К. пара происходит при его парциальном давлении, соответствующем
линии насыщения чистого вещества. Молекулы газа скапливаются у поверхности раздела
фаз и затрудняют К., снижая её скорость, однако появляющийся градиент концентраций
вызывает их диффузию.
- коэф. конденсации, различный для разных веществ, рн - равновесное
давление (давление насыщения при температуре Т), т - масса молекулы. Если
в газовой фазе присутствует
неконденсирующий газ, то К. пара происходит при его парциальном давлении, соответствующем
линии насыщения чистого вещества. Молекулы газа скапливаются у поверхности раздела
фаз и затрудняют К., снижая её скорость, однако появляющийся градиент концентраций
вызывает их диффузию.
Если первоначально пар
не сосуществует с конденсированной фазой, то он может перейти в метастабиль-ное
состояние, характеризуемое степенью пересыщения 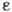 =р/рн. При высоких степенях пересыщения внутри парогазовой смеси
даже в отсутствие конденсирующих поверхностей может начаться процесс К. Кинетика
нач. стадии такой объёмной К. описывается теорией гомогенного зародышеобразования.
Высокая степень пересыщения создаётся при быстром расширении пара в потоке,
при смешении пара с холодным газом, в молекулярных пучках. Образование зародышевых
капель облегчается на смачиваемых стенках, твёрдых частицах (гетерогенное зародышеобразование)
и на ионах (напр., в Вильсона камере).
=р/рн. При высоких степенях пересыщения внутри парогазовой смеси
даже в отсутствие конденсирующих поверхностей может начаться процесс К. Кинетика
нач. стадии такой объёмной К. описывается теорией гомогенного зародышеобразования.
Высокая степень пересыщения создаётся при быстром расширении пара в потоке,
при смешении пара с холодным газом, в молекулярных пучках. Образование зародышевых
капель облегчается на смачиваемых стенках, твёрдых частицах (гетерогенное зародышеобразование)
и на ионах (напр., в Вильсона камере).
К. и испарение играют важную
роль в круговороте воды в природе, а также в разл. технол. процессах. На тепловых
и атомных электростанциях К. отработанного водяного пара происходит при низком
давлении (ок. 4 КПа). На смачиваемой твёрдой охлаждаемой поверхности конденсат
образует сплошную плёнку, к-рая ухудшает теплообмен между паром и стенкой. В
отсутствие смачивания наблюдается капельный режим К., к-рый предпочтительнее
плёночного, однако при длит. работе несмачиваемая поверхность обычно становится
смачиваемой. К. используется также в холодильных машинах, в ожижителях газов,
в опреснительных и ректификационных установках. Кроме К. на твёрдой поверхности
в технике применяют К. на струях и каплях предварительно охлаждённой жидкости.
Неравновесная К. на твёрдой
поверхности с температурой 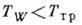 (Tтp - темп-pa тройной точки) может идти по схеме пар
(Tтp - темп-pa тройной точки) может идти по схеме пар  жидкость
жидкость кристалл. Для ряда веществ экспериментально показано, что ниж. граница перехода
к механизму К. пар-кристалл лежит при
кристалл. Для ряда веществ экспериментально показано, что ниж. граница перехода
к механизму К. пар-кристалл лежит при 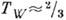 Tтp (см. Кристаллизация ).Неравновесная К. на охлаждаемой
подложке (напр., для воды при
Tтp (см. Кристаллизация ).Неравновесная К. на охлаждаемой
подложке (напр., для воды при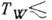 120 К) может приводить к образованию твёрдого аморфного (стеклообразного)
слоя вещества.
120 К) может приводить к образованию твёрдого аморфного (стеклообразного)
слоя вещества.

В. П. Скрипов
|
|