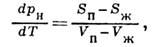
где Sп-Sж и Vп-Vж - скачки энтропии и объёма при фазовом переходе жидкость - пар. Для нахождения рн используются эмпирич. выражения, напр.
Испарение - переход вещества из жидкого или твёрдого состояния в газообразное (пар), обычно со свободной
поверхности. Чаще всего под И. понимают переход жидкости в пар, он
обусловлен разностью хим. потенциалов жидкости и пара. И. твёрдых тел
наз. возгонкой или сублимацией. И. является фазовым переходом первого рода.
При И. совершается работа по преодолению сил сцепления в жидкости (работа выхода)
за счёт кинетич. энергии молекул, в результате чего жидкость
охлаждается. Кол-во теплоты, к-рое нужно сообщить жидкости при
изотермич. образовании единицы массы пара, наз. теплотой парообразования. В отличие от кипения,
И. происходит при любой температуре, причём с повышением температуры
скорость И. возрастает вследствие уменьшения работы выхода и увеличения
доли молекул, обладающих необходимой кинетич. энергией, теплота
испарения уменьшается, обращаясь в нуль в критич. точке.
В замкнутой системе жидкость - пар при пост, темпре Т со временем устанавливается равновесное давление - давление насыщенного пара рн(Т).
Этому давлению соответствует равенство потоков испаряющихся и
конденсирующихся (возвращающихся обратно в жидкость из пара) молекул.
Производная dpн/dT>0 определяется Клапейрона - Клаузиуса уравнением:
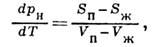
где Sп-Sж и Vп-Vж - скачки энтропии и объёма при фазовом переходе жидкость - пар. Для нахождения рн используются эмпирич. выражения, напр.
lgpн = А-B/T+ClgT +DT6,
где А, В, С, D - индивидуальные для данного вещества постоянные.
На фазовой диаграмме однокомпонентной системы (рис.) равновесная кривая рн(Т) расположена между тройной и критич. точками. В области температур Т ниже температуры Та тройной точки эта кривая имеет метастабильное продолжение ab',
где стабильным фазам соответствует равновесие кристалл - пар. Разные
вещества имеют характерные фазовые диаграммы, широко разнесённые на
плоскости р, Т. В координатах lg(pн/pк),
Тк/Т (где рк, Тк
- критич. давление и темп-pa) кривые сближаются, но не стягиваются в
одну линию. Для неассоциированных жидкостей набор таких кривых с хорошим
приближением можно рассматривать как однопараметрич. семейство рн/рк- f(Т/Тк, А). Параметр термодинамич. подобия (критерий подобия) А можно использовать для описания и др. свойств веществ в области газожидкостных состояний.
Для капель жидкости радиуса r равновесное давление пара рr при заданной температуре больше (а для пузырьков пара в жидкости - меньше), чем давление насыщения
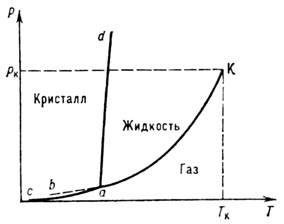
Фазовая диаграмма однокомпонентной системы с одной нормально плавящейся
кристаллич. фазой: а - тройная точка; к - критическая точка; ак - линия
равновесия жидкость - пар; ас, ad - линии равновесия кристалл - пар и
кристалл - жидкость соответственно.
при плоской границе раздела (см. Капиллярные явления ).Приближённо зависимость отношения рr/рн от r описывает Кельвина уравнение: рr/рн=ехр(2sVж/rRT), где s - поверхностное натяжение, Vж - объём жидкости. Т. о., И. выше для мелких капель и крупные капли могут расти за их счёт (см. Атмосфера). При интенсивном испарении жидкости плотность пара вблизи поверхности ниже, чем при изотермич. равновесии фаз. Для установления стационарного потока массы испаряющегося вещества jм необходим подвод к поверхности такого стационарного потока теплоты jq, чтобы jq/jм@L+DEп, где L - теплота фазового перехода, Eп - превышение внутр. энергии единицы массы пара над равновесной энергией. При интенсивных потоках подводимой энергии, напр, при лазерном нагреве, когда DEпдL, И. мало связано с условиями фазового равновесия системы жидкость - пар и определяется газодинамич. условиями у поверхности раздела фаз. При И. сферич. частиц в поле очень мощного лазерного излучения за счёт реактивной отдачи получены давления до 1016 Па и сжатие мишени до плотностей, превышающих плотность исходной конденсированной фазы на два порядка. И. играет важную роль в энергетике, холодильной технике, в процессах сушки, испарительного охлаждения и т. д. В системе из двух или более компонент равновесный состав пара отличается от состава жидкой фазы, что используется для разделения (очистки) веществ (метод перегонки).

В. Я. Скрипов
|
|