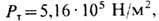 для тройной точки воды - основной реперной точки абс. термодинамич. температурной
шкалы -
для тройной точки воды - основной реперной точки абс. термодинамич. температурной
шкалы - 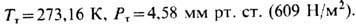
Тройная точка - точка пересечения кривых фазового равновесия на плоской диаграмме состояния
вещества, соответствующая устойчивому равновесию трёх фаз. Из Гиббса
правила фаз следует, что химически однородное вещество (однокомпонентная
система) в равновесии не может иметь больше трёх фаз. Эти три фазы (напр., твёрдая,
жидкая и газообразная или, как у серы, жидкая и две аллотропные разновидности
кристаллической) могут совместно сосуществовать только при значениях температуры
Tт и давления Рт, определяющих на диаграмме
Р-Т координаты Тройная точки (рис.). Для СО2, напр., Tт
= 216,6 К, 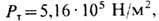 для тройной точки воды - основной реперной точки абс. термодинамич. температурной
шкалы -
для тройной точки воды - основной реперной точки абс. термодинамич. температурной
шкалы - 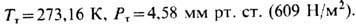
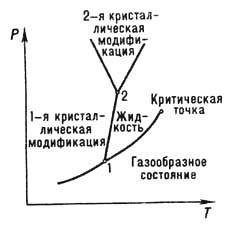
Тройные точки (1 и 2)
на диаграмме состояния в координатах
Р- Т (давление - температура).
При увеличении числа компонентов системы (раствора или сплава) увеличивается и число независимых параметров, характеризующих эту систему. Так, для двухкомпо-нентной системы, помимо Р и Г, добавляется третий параметр-концентрация с. Пространственная диаграмма состояния такой системы в координатах Р, T, с имеет уже не тройной точку, а тройную пространственную кривую. Равновесие трёх фаз для такой системы будет изображаться точкой, если считать один из параметров (напр., Р)постоянным, т. е. рассматривать плоскую диаграмму равновесия. Вообще тройные точки существуют на плоских диаграммах состояния систем с любым числом компонентов, если все параметры, определяющие состояние системы, кроме двух, приняты за постоянные.

|
|