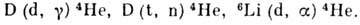
Дейтерий (от греч. deuteros-второй; лат. Deuterium), D или 2H,- тяжёлый стабильный изотоп
водорода с массовым числом 2; содержание в природном водороде 0,0156% (по массе).
Масса 2,0141018 а. е. м. Ядро Д.- дейтрон - состоит из 1 протона и 1
нейтрона. Д. открыт в 1932 Г. Юри (H. Urey) совм. с сотрудниками спектральным
методом.
Большое различие масс Д.
и протия (1H) обусловливает различие их свойств (изотопные эффекты).
Так, tкип вещества, состоящего из молекул D2, -23,57К,
межъядерное расстояние в молекуле D2-0,07416 нм, энергия диссоциации
D2 (при OK) 439,68 кДж/моль (ср. с соответствующими значениями для
H2 в ст. Водород ).Скорости химических реакций с участием
веществ, содержащих Д., могут быть в 5-10 раз выше или ниже, чем с участием
таких же веществ, содержащих протий.
Д. выделяют на основе различий
свойств протия и Д. Так, используют особенность изотопного обмена в системе
вода - сероводород, применяют ректификацию жидкого водорода, многоступенчатый
электролиз водных растворов и т. д.
Д. служит меченым стабильным
индикатором при проведении разл. хим., биохим. и др. исследований. Тяжёлая вода
D2O представляет собой лучший из известных замедлителей нейтронов.
В водородных бомбах используется гидрид лития 6LiD; при взрыве водородной
бомбы протекают термоядерные реакции:
В будущем Д., возможно, станет основным ядерным топливом.
Дейтерий (тяжелый водород) D, стабильный изотоп водорода с мас. ч. 2, ат. м. 2,01416219. Ядро атома дейтерия - дейтрон состоит из одного протона и одного нейтрона, энергия связи между ними 2,23 МэВ. Поперечное сечение ядерной р-ции (n,g) 53.10-33 м2, поперечное сечение захвата тепловых нейтронов дейтронами 15.10-32 м2 (для протонов 3.10-29м2). Молекула двухатомна, длина связи 0,07417 нм; осн. частота колебаний атомов 3118,46 см-1; энергия диссоциации 440 кДж/моль, константа диссоциации К = p2D/pD2 = 4,173.10-73 (293,15 К). С др. изотопами водорода дейтерий образует молекулы протодейтерия HD (мол. м. 3,02205) и дейтеротрития DT (мол. м. 5,03034). В прибрежной морской воде соотношение D/(D + Н) составляет (155-156).10-6, в поверхностных водах - (132-151).10-6, в прир. газе - (110-134).10-6.
Свойства. Коэф. сжимаемости дейтерия (pV/RT)при 273,15 К: 1,0121 (2,0266 МПа), 1,0624(10,133 МПа), 1,130(20,266 МПа). С° [в Дж/(моль.К)]: 20,81 (20 К), 30,11 (100 К), 29,30 (298 К); теплопроводность 0,135 Вт/(м.К) (25 К); h 1,23.10-2 мПа.с (293,15 К). Дейтерий раств. в жидкостях (напр., в бензоле, толуоле, октане, гептане, ССl4, CS2) лучше, чем Н2, причем это различие возрастает с понижением т-ры.
Молекула D2 может находиться в орто- и пара-состояниях. Ортодейтерий (o-D2) имеет параллельную (одного знака) ориентацию ядерных спинов, а парадейтерий (п-D2) -антипараллельную. Это обусловливает нек-рое различие магн., оптич. и термич. св-в разл. модификаций. При обычных условиях D2 (нормальный дейтерий, н-D2) представляет собой
смесь 2/3 орто- и 1/3 пара-модификаций, к-рые могут взаимно превращаться друг в друга (орто-пара-превращение). Каждой данной т-ре соответствует определенный равновесный состав (равновесный дейтерий, p-D2). Так, доля п-D2 составляет: 0,333 (при 300 К), 0,251 (60 К), 0,148 (40 К), 0,019 (20 К). При низких т-рах термодинамически стабилен o-D2. Самопроизвольное орто-пара-превращение при низких т-рах происходит очень медленно, что позволяет получить жидкий дейтерий, близкий по составу к нормальному. Орто-пара-превращение ускоряется в присут. катализаторов (соед. Fe, Сr, Со, Мn, РЗЭ). Св-ва дейтерия приведены в табл. 1 и 2.

Ур-ние температурной зависимости давления пара над твердым и жидким дейтерием: lg 0,0075p (Па) = А - В/Т + СT (значения А, В и С приведены в табл. 3).

Теплота испарения o-D2 (в Дж/моль): 1202,9 (24,25 К), 1029,5 (30,53 К).
Твердый D2 имеет тетрагон, объемноцентрированную решетку, а = 0,338 нм, с = 0,560 нм; т. пл. 18,73 К. Н2 и D2 не изоморфны, обнаружена их ограниченная взаимная р-римость в твердом состоянии. При 4,2 К предельная р-римость D2 в Н2 ок. 10% по объему, а р-римость Н2 в D2 21%.
По хим. св-вам D2 аналогичен Н2, однако скорость р-ций при замещении Н на D заметно уменьшается, напр., при окислении орг. соед., взаимод. Н2 с Сl2 - в 5-10 раз. При электролизе воды D2 выделяется медленнее, чем Н2.
Важное практич. значение имеют р-ции изотопного обмена дейтерия. Константа равновесия р-ции Н2 + D2 D 2HD составляет: 1,345 (50 К), 2,903 (200 К), 3,44 (373,15 К), 3,80 (700 К). Осуществляют ее в присут. катализатора (Pt, Ni, РЗЭ). Для р-ции НDО(ж) + D2(г) D D2О(ж) + HD(г) (где ж -жидкость, г - газ) константа равновесия: 3,96 (223,15 К), 2,92 (323,15 К), 2,40 (373,15 К). Для р-ции Н2О(ж) + HD D НDО(ж) + Н2(г) константа равновесия: 4,69 (223,15 К), 3,37 (323,15 К), 2,69 (373,15 К). Изотопный обмен между водой и D2 или HD может протекать в паровой фазе в присут.
катализаторов (напр., Ni) или в жидкой под давлением (из-за плохой р-римости изотопов водорода в воде) в присут. катализаторов (в т. ч. гидрофобных) в гомог. или гетерог. системе. Нек-рые р-ции изотопного обмена Н протекают очень быстро, напр., в группах ОН (щелочи, спирты) и NH (NН3, амины).
Важнейшие соед. дейтерия- тяжелая вода D2O. Дейтериды соед., аналогичные гидридам. Большое практич. значение имеет дейтерид лития 6LiD - ocн. компонент заряда термоядерного (водородного) оружия.
Для аналит. определения дейтерия применяют масс-спектрометрич., спектральные, хроматографич., а также денсиметрические (путем измерения плотности) методы изотопного анализа.
Получение. Дейтерий выделяют гл. обр. из тяжелой воды, напр., электролизом, р-цией с металлами. Дейтерий получают также низкотемпературной ректификацией из электролитич. водорода или азотоводородной смеси для синтеза NH3 (водород к-рой содержит 250-300 м. д. HD). Исходный водород или азото-водородную смесь после тщательной очистки от примесей (О2 до 10-9 мольных долей, остальные газы - до 10-7-10-8 мольных долей) сжижают и двухступенчатой ректификацией при 22-24 К выделяют конц. HD. Последний в присут. катализатора превращается в смесь Н2 + D2 + HD, из к-рой низкотемпературной ректификацией получают 99,8%-ный D2. Сжиганием с воздухом или О2 последний переводят в тяжелую воду.
Применение. Дейтерий (в виде D2О) - замедлитель нейтронов в ядерных реакторах. Дейтроны, обычно получаемые путем ионизации атомов дейтерия, используются в качестве бомбардирующих частиц в ядерных р-циях, в частности для получения быстрых нейтронов. Дейтерий применяется также как изотопный индикатор в научных исследованиях в химии, биологии, физиологии, агрохимии и др. (в т.ч. в опытах с живыми организмами и при диагностич. исследованиях человека). Соед. дейтерия используются также при спектроскопич. исследованиях. Изделия из монокристаллов на основе KD2PO4 применяются для создания систем управления и преобразования лазерного излучения. Дейтерий - ядерное топливо для энергетики будущего, основанной на управляемом термоядерном синтезе. В первых энергетич. реакторах такого типа предполагается осуществить р-цию D + T D He + n + 17,6 МэВ.
Дейтерий открыт Г. Юри с сотрудниками в 1932.
===

Релятивисты и позитивисты утверждают, что "мысленный эксперимент" весьма полезный интрумент для проверки теорий (также возникающих в нашем уме) на непротиворечивость. В этом они обманывают людей, так как любая проверка может осуществляться только независимым от объекта проверки источником. Сам заявитель гипотезы не может быть проверкой своего же заявления, так как причина самого этого заявления есть отсутствие видимых для заявителя противоречий в заявлении.
Это мы видим на примере СТО и ОТО, превратившихся в своеобразный вид религии, управляющей наукой и общественным мнением. Никакое количество фактов, противоречащих им, не может преодолеть формулу Эйнштейна: "Если факт не соответствует теории - измените факт" (В другом варианте " - Факт не соответствует теории? - Тем хуже для факта").
Максимально, на что может претендовать "мысленный эксперимент" - это только на внутреннюю непротиворечивость гипотезы в рамках собственной, часто отнюдь не истинной логики заявителя. Соответсвие практике это не проверяет. Настоящая проверка может состояться только в действительном физическом эксперименте.
Эксперимент на то и эксперимент, что он есть не изощрение мысли, а проверка мысли. Непротиворечивая внутри себя мысль не может сама себя проверить. Это доказано Куртом Гёделем.
Понятие "мысленный эксперимент" придумано специально спекулянтами - релятивистами для шулерской подмены реальной проверки мысли на практике (эксперимента) своим "честным словом". Подробнее читайте в FAQ по эфирной физике.
|
|