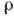 в кристалле, к-рое рассчитывается как ряд Фурье:
в кристалле, к-рое рассчитывается как ряд Фурье:Кристаллическая структура - расположение атомов, ионов, молекул в кристалле. Кристалл с определ. хим.
ф-лой имеет присущую ему К. с., обладающую трёхмерной периодичностью - кристаллической
решеткой. Термин "К. с." употребляют вместо термина "кристаллич.
решётка", когда речь идёт об энергии решётки, динамике решётки, о решётке
как конкретной структуре того или иного хим. соединения, об описании атомного
строения конкретных соединений и их модификаций. Геом. описание конкретной К.
с. состоит в указании координат центров атомов в элементарной ячейке кристалла,
что позволяет определять межатомные расстояния и тем самым изучать геом. особенности
К. с.
Осн. методами исследования
К. с. являются дифракционные - рентгеновский структурный анализ, нейтронография,
электронография. Дифракционные методы дают непрерывное, усреднённое по времени
и по всему объёму кристалла распределение рассеивающей материи
в элементарной ячейке К. с. Методами рентг. анализа получают распределение электронной
плотности 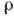 в кристалле, к-рое рассчитывается как ряд Фурье:
в кристалле, к-рое рассчитывается как ряд Фурье:
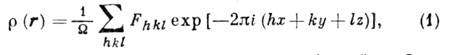
где х, у, z - координаты
в элементарной ячейке, 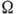 - её объём, Fhkl - коэф. Фурье, наз. структурными амплитудами.
Распределение электронной плотности
- её объём, Fhkl - коэф. Фурье, наз. структурными амплитудами.
Распределение электронной плотности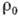 в ячейке можно приближённо представить как сумму электронных плотностей атомов
в ячейке можно приближённо представить как сумму электронных плотностей атомов
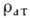 (ri):
(ri):
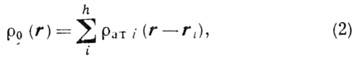
где 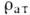 i
- усреднённые во времени, т. е. размазанные тепловым движением, распределения
электронов в атоме. Максимумы (1) соответствуют атомам - сгусткам электронной
плотности, что позволяет найти координаты их центров r (х, у , z )
и создать геом. модель, установив межатомные расстояния с точностью до 0,0001
- 0,00001 нм.
i
- усреднённые во времени, т. е. размазанные тепловым движением, распределения
электронов в атоме. Максимумы (1) соответствуют атомам - сгусткам электронной
плотности, что позволяет найти координаты их центров r (х, у , z )
и создать геом. модель, установив межатомные расстояния с точностью до 0,0001
- 0,00001 нм.
В нейтронографии аналогично
(1) по амплитудам ядерного рассеяния кристалла Fнейтр определяют
распределение ядерной плотности п(r)ячейки, т. е. вероятностное, размазанное
тепловым движением распределение ядер (см. Нейтронография структурная ).При
наличии у атомов магн. момента нейтронографически определяют магн. К. с.- распределение
спиновой плотности (см. Магнитная нейтронография ).В электронографии
по амплитудам Fэл согласно (1) определяют распределение электростатич.
(суммарного - ядер и электронов) потенциала 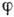 (r). Положение максимумов всех трёх распределений совпадает - это и есть среднее
во времени положение центров атомов (ядер) в элементарной ячейке.
(r). Положение максимумов всех трёх распределений совпадает - это и есть среднее
во времени положение центров атомов (ядер) в элементарной ячейке.
Геометрическая модель.
Для создания геом. модели К. с. необходимо: знание параметров элементарной ячейки
(параллелепипеда повторяемости) структуры - в общем случае длин её рёбер а,
Ь, с и углов 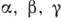 ; указание симметрии К. с., т. е. принадлежности её к одной из 230 пространственных
групп (см. Симметрия кристаллов)и тем самым - типу Браве решётки;
указание координат всех химически различных атомов и симметрии их позиций.
Для этого достаточно знать координаты атомов в симметрически независимой части
ячейки, из к-рых можно с учётом операций пространственной группы вывести положение
всех атомов К. с. На этой основе рассчитываются межатомные расстояния, взаимная
координация атомов и др. геом. характеристики К. с. Графически К. с. изображают
расположением атомов ("шариков") в элементарной ячейке (рис. 1,
а). Крупными соприкасающимися "шарами" в случае необходимости можно
показать контакты атомов в плотноупакованных неорганич. (рис. 1, б)или
молекулярных структурах. Для изображения ионных К. с. часто пользуются полиэдрами,
в вершинах к-рых находятся анионы, в центрах - катионы (рис. 1, в).
; указание симметрии К. с., т. е. принадлежности её к одной из 230 пространственных
групп (см. Симметрия кристаллов)и тем самым - типу Браве решётки;
указание координат всех химически различных атомов и симметрии их позиций.
Для этого достаточно знать координаты атомов в симметрически независимой части
ячейки, из к-рых можно с учётом операций пространственной группы вывести положение
всех атомов К. с. На этой основе рассчитываются межатомные расстояния, взаимная
координация атомов и др. геом. характеристики К. с. Графически К. с. изображают
расположением атомов ("шариков") в элементарной ячейке (рис. 1,
а). Крупными соприкасающимися "шарами" в случае необходимости можно
показать контакты атомов в плотноупакованных неорганич. (рис. 1, б)или
молекулярных структурах. Для изображения ионных К. с. часто пользуются полиэдрами,
в вершинах к-рых находятся анионы, в центрах - катионы (рис. 1, в).
Геом. анализ К. с. позволил
развить целый ряд обобщений и законов атомной структуры кристаллов- представления
об атомных радиусах, о типах хим. связи в кристаллах (ионной, ковалентной, металлической,
ван-дер-ваальсовой, водородной), правила плотнейшей упаковки атомов и молекул
в К. с., связи К. с. со свойствами кристаллов (см. Кристаллохимия ).Анализ
К. с. и её симметрии служит отправным пунктом расчётов энергетич. спектра, истолкования
физ. свойств кристалла (см. Кристаллофизика).
Параметры элементарных
ячеек некоторых кристаллов
|
Типы кристаллов |
Периоды элементарной
ячейки, нм |
Число атомов в
элементарной ячейке |
||
|
Химические элементы,
простейшие соединения |
0.5-1.0 |
~10 |
||
|
Неорганические
и простые молекулярные соединения |
1.0-2.0 |
до сотен |
||
|
Сложные органические
соединения |
2.0-4.0 |
до тысяч |
||
|
Белки |
до 10-30 |
103-105 |
||
|
Вирусы |
до 200 |
106-109 |
||
Изучено более 100 тыс.
К. с. разл. веществ, из них ок. 20 тыс. неорганич. К. с. элементов, разл. соединений,
минералов, остальную - большую часть - составляют органич. К. с. Периоды решётки
разл. кристаллов составляют от долей до сотен нм (табл.). Рентге-ноструктурный
анализ К. с. органич. соединений есть наиб. точный и достоверный метод определения
пространственного и хим. строения составляющих их молекул. Изучено неск. сотен
К. с. сложнейших веществ биол. происхождения: белков, нуклеиновых кислот, вирусов
(см. Биологический кристалл ).Существуют международные ЭВМ-банки данных,
описывающие все неорганич., органич. и биологич. К. с.
Рис. 1. Модели кристаллических
структур: а - алмаз, б - хлористый натрий NaCl, в - бафертисит
BaFe2Tl (Si2O7)O(OH).
Совр. прецизионные дифракционные
методы позволяют, кроме координат атомов (геом. модели), определять др. характеристики
К. с.
Тепловые колебания атомов.
Амплитуда тепловых колебаний атомов, приблизительно обратно пропорциональная
силам хим. связей между атомами в К. с., обратно пропорциональна массе атомов
и прямо пропорциональна температуре Т. В первом приближении сферически симметричных
(изотропных) колебаний вероятность (r)нахождения центров атомов па расстоянии г от идеальной позиции описывают
гауссовским распределением
(r)нахождения центров атомов па расстоянии г от идеальной позиции описывают
гауссовским распределением
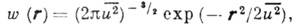
где 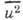 -
среднеквадратичное смещение атома. Величины
-
среднеквадратичное смещение атома. Величины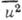 определяются экспериментально по спаду интен-сивностей дифракционных отражений.
В общем случае анизотропных колебаний
определяются экспериментально по спаду интен-сивностей дифракционных отражений.
В общем случае анизотропных колебаний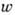 (r)каждого атома характеризуется тремя параметрами
(r)каждого атома характеризуется тремя параметрами 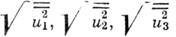 полуосей эллипсоида
тепловых колебаний и тремя углами, задающими ориентацию эллипсоида (рис. 2,
а)(это определяет 6 компонент симметричного тензора 2-го ранга). Обычно
изображают эллипсоид, соответствующий тому, что интеграл по w(r)внутри
него равен 0,5, тогда полуоси эллипсоида равны 1,54
полуосей эллипсоида
тепловых колебаний и тремя углами, задающими ориентацию эллипсоида (рис. 2,
а)(это определяет 6 компонент симметричного тензора 2-го ранга). Обычно
изображают эллипсоид, соответствующий тому, что интеграл по w(r)внутри
него равен 0,5, тогда полуоси эллипсоида равны 1,54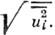 Величины
Величины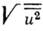 в
К. с. колеблются от 0,005-0,015 нм (ковалентные неорганич. кристаллы, металлы,
неорганич. соединения) и до 0,02-0,03 нм для органич. кристаллов, в к-рых вандер-ваальсовы
связи между молекулами слабы. В колебаниях атомов органич. кристаллов можно
выделить колебания молекулы как целого и внутримолекулярные атомные
колебания. Для алмаза
в
К. с. колеблются от 0,005-0,015 нм (ковалентные неорганич. кристаллы, металлы,
неорганич. соединения) и до 0,02-0,03 нм для органич. кристаллов, в к-рых вандер-ваальсовы
связи между молекулами слабы. В колебаниях атомов органич. кристаллов можно
выделить колебания молекулы как целого и внутримолекулярные атомные
колебания. Для алмаза 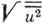 =0,002
нм. При
=0,002
нм. При
повышении температуры перед
плавлением 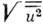 достигает прибл. 0,1 от межатомных расстояний и К. с. становится неустойчивой,
происходит переход в жидкость.
достигает прибл. 0,1 от межатомных расстояний и К. с. становится неустойчивой,
происходит переход в жидкость.
Экспериментально можно детально определить ан-гармонизм тепловых колебаний атомов К. с., описываемый тензорами более высокого ранга. Поверхность, характеризующая колебания, уже не является трёхосным гауссовым эллипсоидом и не имеет центра симметрии. Параметры энгармонизма позволяют связать характер колебаний атомов с акустич., сегнетоэлектрич. свойствами кристаллов, указать возможные смещения атомов при фазовых переходах в высокотемпературные модификации К. с. Частоты колебаний атомов в К. с. составляют порядка 1012 Гц, их определяют спектроскопич. методами, методом неупругого рассеяния нейтронов (см. Колебания кристаллической решётки).
-
Рис. 2. Эллипсоиды тепловых
колебаний атомов в решётке: а - общий случай произвольной ориентации;
б - анизотропия колебаний в структуре, 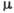 - ацетилена - bis-циклопентадиена никеля при З00 К. Слева - молекулы ацетилена,
справа - циклопентадиена.
- ацетилена - bis-циклопентадиена никеля при З00 К. Слева - молекулы ацетилена,
справа - циклопентадиена.
Вычитая из наблюдаемого
распределения  (r)(1) распределение
(r)(1) распределение 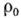 (r)(2), можно найти деформационную электронную
плотность кристаллической структуры.
(r)(2), можно найти деформационную электронную
плотность кристаллической структуры.
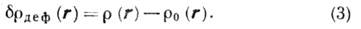
Дело в том, что выражение
(2) является суммой свободных "проатомов" К. с., размазанных тепловым
движением, электронная плотность к-рых не изменена вследствие образования хим.
связи в К. с., а выражение (1) соответствует электронной плотности кристалла,
в к-рой все эти связи образовались. Несмотря на то, что значения 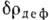 невелики, они позволяют выявить ряд тонких деталей К. с. (рис. 3). Так, появление
максимума
невелики, они позволяют выявить ряд тонких деталей К. с. (рис. 3). Так, появление
максимума 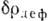 на месте "проатома" показывает на излишек электронов в нём, т. е.
что этот атом заряжен отрицательно, т. к. является анионом, а появление минимума
- что он является катионом; по величине drдеф можно оценить степень
ионизации. В ионных К. с. электроны перераспределяются между атомами, но в "межатомном
пространстве" практически
на месте "проатома" показывает на излишек электронов в нём, т. е.
что этот атом заряжен отрицательно, т. к. является анионом, а появление минимума
- что он является катионом; по величине drдеф можно оценить степень
ионизации. В ионных К. с. электроны перераспределяются между атомами, но в "межатомном
пространстве" практически 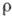 =0.
В металлич. К. с. часть электронов атомов обобществлена и образует равномерную
электронную плотность межатомного пространства. В ковалентных кристаллах
=0.
В металлич. К. с. часть электронов атомов обобществлена и образует равномерную
электронную плотность межатомного пространства. В ковалентных кристаллах 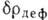 отчётливо выявляет пики
отчётливо выявляет пики 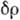 между атомами, соответствующие парам электронов, образующих ковалентную связь.
В молекулярных кристаллах фиксируются пики
между атомами, соответствующие парам электронов, образующих ковалентную связь.
В молекулярных кристаллах фиксируются пики 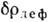 ,
соответствующие неподелённым электронным парам атомов (рис. 3). Математич. обработка
,
соответствующие неподелённым электронным парам атомов (рис. 3). Математич. обработка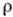 (r)и
(r)и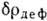 позволяет
находить распределение электростатич. потенциала электронов, потенциальную энергию,
градиент поля на атомах и т. п. С помощью электронографии можно находить суммарный
(ядер и электронов) деформац. потенциал атомов
позволяет
находить распределение электростатич. потенциала электронов, потенциальную энергию,
градиент поля на атомах и т. п. С помощью электронографии можно находить суммарный
(ядер и электронов) деформац. потенциал атомов 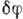 и определять их заряд.
и определять их заряд.
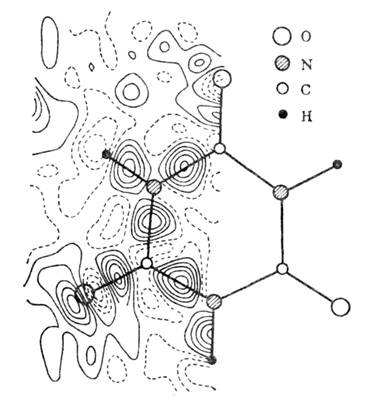
Рис. 3. Деформационная
электронная плотность циануровой кислоты. Пики на связях - валентные связывающие
электроны, около атома О -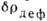 неподелённая электронная пара.
неподелённая электронная пара.
Дефекты. К. с., в к-рой
все позиции заполнены атомами, наз. идеальной К. с. Однако в действительности
К. с. имеет ряд дефектов - точечных (смещения атомов из идеальных позиций, замещение
этих атомов атомами примеси, вакансии, атомы внедрения и т. п.), линейных и
двумерных (дислокации, ошибки в наложении слоев и т. п.) (см. Дефекты в
кристаллах). Если количество точечных дефектов велико, можно фиксировать среднее
по всем ячейкам изменение бр электронной плотности К. с., напр. в рубине А1203+0,05%
Сr, где Сг замещает позиции А1. В структурах твёрдых растворов вычитания или
внедрения анализ бр даёт сведения о заселённости атомами тех или иных позиций.
Наряду с кристаллич. веществами,
в к-рых атомы колеблются около фиксиров. положений равновесия, существуют кристаллы,
в к-рых отд. атомы, их группировки или целые молекулы статистически занимают
разл. положения (см.
Твёрдые растворы ).Тепловое движение молекул в нек-рых кристаллич. структурах
таково, что при сохранении положения центра тяжести они могут быть в состоянии
сферич. или цилиндрич. вращения. В нек-рых кристаллах при наличии жёсткого трёхмерно-периодич.
каркаса структуры из одних атомов нек-рые ионы могут свободно мигрировать, перетекать
по каналам каркаса (см. Ионные суперпроводники ).Пути миграции заряженных
ионог фиксируются распределением drдеф. Аналогично в каркасных К.
с., напр. цеолитах, внутри пустот могут находиться молекулы органич. веществ,
также фиксируемые по dr.

Рис. 4. Электронно-микроскопическое
изображение атомной структуры кластера фосфора в кремнии.
Конкретное расположение
дефектов в реальной К. с. исследуется также методами рентгеновской и нейтронной
топографии, электронной микроскопии (рис. 4) и др.
Сложные К. с. Наряду
с идеальными трёхмернопериодич. К. с. существуют др. типы кристаллич. упорядоченности
атомов. Так, в сверхструктурах на "фоне" правильной трёхмерной решётки
наблюдается дополнит. упорядоченность с периодами, кратными одномуили двум периодам
идеальной К. с., обязанная, напр., распределению магн. моментов атомов, электрич.
диполей и т. п. Иногда период такой сверхструктуры не кратен периоду основной
решётки, и тогда К. с. наз. несоразмерной. К. с. с периодическими в к--л. направлении
включениями инородных атомов наз. модулированными. Искусственно приготовляемые
в микроэлектронике гетероструктуры, напр. AlAs-GaAs, имеют общую, одну и ту
же кристаллич. решётку (в смысле равенства периодов), но в них чередуются слои
то одного, то другого состава (рис. 5). Существуют К. с. (напр., слоистые силикаты)
с неупорядоченным наложением двух пли более сортов слоев фиксиров. строения,
напр. структуры из сочленённых "лент" или "колонок"
фиксиров. состава. Всё это - фактически когерентное сцепление в едином кристалле
на атомном уровне микроучастков разл. К. с.

Рис. 5. Электронная микрофотография
расположения атомов в гетероструктуре AlAs-GaAs (увеличение  106).
106).
Более сложные нарушения
упорядоченности, приводящие к частичной или полной потере осн. признака К. с.-
дальнего порядка (см. Дальний и ближний порядок ),наблюдаются в структуре
полимеров, жидких кристаллов, квазикристаллов.
К. с. конкретных веществ классифицируются по симметрии и тину хим. связей. Многие вещества разного хим. состава, но с одинаковым соотношением числа атомов имеют геометрически подобные К. с., что наз. из о структурностью (напр., MgO и TiN - структурный тип NaCl). Из симметрии К. с. можно предсказать возможные в данном кристалле физ. свойства. Количественные характеристики разных свойств, например упругих, оптических, электрических и т. п., можно увязать с конкретным расположением атомов в К. с., а иногда и прямо рассчитать из К. с. (см. Кристаллы)

|
|