Интерметаллические соединения (металлические соединения, металлиды) - в узком смысле кристаллы, представляющие собой соединения металлов друг с другом; в широком смысле двух- или многокомпонентные кристаллы, электронное строение к-рых имеет характерные признаки металла (или полупроводника). Кристаллич. структуры И. с. отличаются от структуры отд. компонент. И. с. формируются из жидких, жидкой и твёрдой, твёрдых фаз, а также из неупорядоченного твёрдого раствора. В последнем случае они наз. фазами Куркакова. Кристаллич. структура И. с. устойчива в огранич. областях изменения состава, температуры

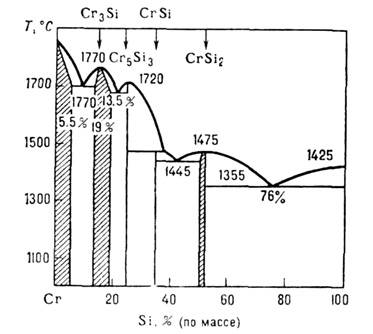
Диаграмма состояния системы Cr-Si; заштрихованы концентрационные области гомогенности. и давления (области гомогенности). Напр., диаграмма состояния системы Сr-Si (рис.) иллюстрирует образование И. с.: Cr3Si, Cr5Si3, CrSi, CrSi2, причём первое и последнее из них отличаются протяжёнными концентрац. областями гомогенности. В И. с. существуют равновесные точечные дефекты типа атомов замещения, внедрения или вакансий, концентрация к-рых больше, чем в однокомпонентных кристаллах. В нек-рых И. с., напр. VH1_x, TiC1_x, Ni1-xAl, a-Fе1_xSi2, концентрация вакансии достигает десятков % от числа узлов решётки. По атомно-кристаллич. и электронному строению различают след, классы И. с.: электронные соединения (фазы Юм - Розери), фазы Лавеса (Cu2Mg, MgZn2, MgNi2), фазы внедрения (гидриды, карбиды, нитриды металлов), И. с. переходных d-металлов друг с другом (s-фазы), И. с. d- и f-металлов о непереходными элементами и др. Электронными соединениями являются, напр., фазы системы Сu-Zn: CuZn (b-фаза), Cu5Zn3 (g-фаза), CuZn3 (e-фаза). Их кристаллич. структура и состав определяются гл. обр. электронной концентрацией, к-рая для перечисленных И. с. близка к 3/2, 31/13, 7/4 (отношение числа валентных электронов к числу атомов). Эти значения соответствуют размерам ферма-поверхности, при к-рых она касается границ первой Бриллюэна зоны для соответствующих кристаллич. структур. Для электронного строения таких И. с. характерно расположение уровня Ферми в энергетич. зоне, образованной s состояниями (зона s-типа), и приблизительная сферичность поверхности Ферми. Фазы Лавеса характеризуются плотными упаковками с чередованием шаровых слоев, напр. АВСАВС, АВАВАВ и АВАСАВАС. Идеальное отношение атомных диаметров 1,225 (у большинства соединений 1,1-1,6). Области гомогенности фаз Лавеса незначительны. Фазы внедрения имеют простые структуры (объёмно центрированная кубич., гранецентрированная и др.), образуются из компонентов, для к-рых отношение атомных диаметров меньше 0,59. Области гомогенности обычно широкие за счёт того, что часть междоузлий матрицы может оставаться незанятой атомами компонента с меньшим атомным диаметром. Для электронного строения карбидов и нитридов переходных металлов характерно формирование энергетич. подзон из s и р-состояний, генетически связанных с атомами С и N, в низко-энергетич. части электронного спектра и расположение уровня Ферми в области d-состояний переходного металла. Межатомное взаимодействие сильное. В И. с. d- и f-металлов с непереходными элементами (В, Al, Ga, Si, Ge и др.) межатомное взаимодействие также велико. Т. к. атомы переходных металлов имеют ближайшими соседями атомы непереходных элементов, то часть d-, f-состояний остаётся не вовлечённой в межатомные связи и формирует узкие подзоны в высокоэнергетич. части электронного спектра. Степень заполнения таких подзон электронами определяет плотность состояний на уровне Ферми и физические свойства И. с. Разнообразие свойств И. с. обеспечивает их практич. использование. Среди И. с. есть сверхпроводники (V3Si, Nb3Ge, Nb3Sn и др.), полупроводники и полуметаллы (GaAs, HgTe, CrSi2, CoB, Mg2Sn и др.), ферромагнетики (SmCo, CoPt и др.), кристаллы с высокими термоэмиссионными свойствами (LaB6). Нек-рые И. с. обладают высокой твёрдостью (WC, TiB2, TiC), жаростойкостью (MoSi2, TiB2), a TaC - высокой температурой плавления.

П. В. Гельд, Ф. А. Сидоренко
Когда тот или иной физик использует понятие "физический вакуум", он либо не понимает абсурдности этого термина, либо лукавит, являясь скрытым или явным приверженцем релятивистской идеологии.
Понять абсурдность этого понятия легче всего обратившись к истокам его возникновения. Рождено оно было Полем Дираком в 1930-х, когда стало ясно, что отрицание эфира в чистом виде, как это делал великий математик, но посредственный физик Анри Пуанкаре, уже нельзя. Слишком много фактов противоречит этому.
Для защиты релятивизма Поль Дирак ввел афизическое и алогичное понятие отрицательной энергии, а затем и существование "моря" двух компенсирующих друг друга энергий в вакууме - положительной и отрицательной, а также "моря" компенсирующих друг друга частиц - виртуальных (то есть кажущихся) электронов и позитронов в вакууме.
Однако такая постановка является внутренне противоречивой (виртуальные частицы ненаблюдаемы и их по произволу можно считать в одном случае отсутствующими, а в другом - присутствующими) и противоречащей релятивизму (то есть отрицанию эфира, так как при наличии таких частиц в вакууме релятивизм уже просто невозможен). Подробнее читайте в FAQ по эфирной физике.
|
|