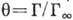 наз. степенью (или долей) покрытия поверхности (
наз. степенью (или долей) покрытия поверхности (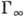 -предельно возможная величина монослой-ной А. для данной системы).
-предельно возможная величина монослой-ной А. для данной системы).Адсорбция (от лат. ad - на, при и sorbeo -
поглощаю) - преимущественное концентрирование молекул газа или
растворённого в жидкости вещества (адсорбата) на поверхности жидкости
или твёрдого тела (адсорбента), а также растворённого в жидкости
вещества на границе её раздела с газовой фазой. Частный случай сорбции. Один из важнейших типов поверхностных явлений.
Явление адсорбции связано с тем, что силы межмолекулярного взаимодействия на границе раздела фаз не скомпенсированы, и, следовательно, пограничный слой обладает избытком энергии - свободной поверхностной энергией. В результате притяжения поверхностью раздела фаз находящихся вблизи неё молекул адсорбата свободная поверхностная энергия уменьшается, т. е. процессы А. энергетически выгодны.
В зависимости от характера взаимодействия молекул адсорбата и адсорбента
различают физическую А. и хемосорбцию. Физ. А. обусловлена силами
межмолекулярного взаимодействия и не сопровождается существ. изменением
электронной структуры молекул адсорбата. Физ. А. может быть как
мо-нослойной (с образованием мономолекулярного слоя), так и полимолекулярной (многослойной). При А. электролитов из их растворов обычно возникает двойной электрический слой .Если жидкий адсорбат смачивает пористый адсорбент, то в порах последнего может происходить капиллярная конденсация .При физ. А. адсорбир. молекулы обычно обладают поверхностной подвижностью.
При хемосорбции между атомами (молекулами) адсорбента и адсорбата
образуется хим. связь, т. о. хемосорбцию можно рассматривать как хим.
реакцию, область протекания к-рой ограничена поверхностным слоем. В
нек-рых случаях на одной поверхности могут протекать оба типа А.
одновременно. В случае не слишком пористых адсорбентов физ. А. имеет
место, как правило, при температуpax ниже критич. температуры конденсации
адсорбата, хемосорбция же чаще всего протекает при гораздо более высоких
температурах. Однако в нек-рых системах физ. А. может протекать при
температуpax, значительно превышающих критич. температуру конденсации адсорбата.
Как и любые хим. реакции, процессы хемосорбции носят специфичный
характер (т. е. адсорбент хемосорбирует не любые молекулы, а лишь те,
к-рые вступают в реакцию с атомами поверхности); в нек-рых случаях
специфичность может проявляться и при физ. А.
Физ. характеристики А. Количеств. характеристикой А.
является величина Г, представляющая собой избыток адсорбата,
приходящийся на единицу площади поверхностного слоя, по сравнению с
кол-вом адсорбата в единицу объёма фазы адсорбента. Отношение 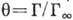 наз. степенью (или долей) покрытия поверхности (
наз. степенью (или долей) покрытия поверхности (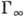 -предельно возможная величина монослой-ной А. для данной системы).
-предельно возможная величина монослой-ной А. для данной системы).
Процессы А. почти всегда сопровождаются
выделением теплоты, наз. теплотой А., к-рая возрастает
с увеличением прочности связи адсорбат - адсорбент и составляет обычно 8-25
кДж/моль (иногда до 80 кДж/моль) для физ. А. и, как правило, превышает 80 кДж/моль
при хемосорбции. Если хемосорбция сопровождается диссоциацией адсорбир. молекул,
может наблюдаться поглощение тепла. По мере заполнения поверхности теплота А.
обычно уменьшается в результате неоднородного распределения свободной энергии
на поверхности или латерального взаимодействия молекул в адсорбир. слое. Для
адсорбентов, обладающих неск. типами адсорбирующих центров (см. ниже), теплота
А. может быть различной для разных типов центров, и распределение свободной
энергии на поверхности является дискретно-неоднородным. При переходе к полимолекулярной
А. теплота А. понижается до величины, близкой к теплоте конденсации адсорбата.
Если теплота А. сравнима с поверхностной энергией адсорбента, то в процессе
А. может существенно меняться кристаллич. структура поверхности твёрдого тела,
причём при физ. А. перестройке подвергаются в осн. поверхности молекулярных
кристаллов, а в случае хемосорбции изменение поверхностной структуры наблюдается
даже для металлов и ионных кристаллов.
Обратный А. процесс, при к-ром адсорбир. частицы покидают поверхность адсорбента, наз. десорбцией.
Десорбция происходит в результате колебат. движения адсорбир. молекул
вдоль направления действия силы притяжения между адсорбатом и
адсорбентом. Период таких колебаний t0 обычно составляет 10-13 с. Скорость А. и скорость десорбции могут быть рассчитаны методами статистич. термодинамики. Скорость медленных процессов хемосорбции в большинстве случаев описывается ур-нием
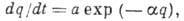
где 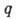 -
кол-во адсорбир. вещества, а и
-
кол-во адсорбир. вещества, а и 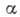 - константы, зависящие от температуры. При равенстве скоростей А. и десорбции устанавливается
адсорбц. равновесие. Ср. продолжительность времени, к-рое частица находится
в адсорбир. состоянии в равновесных условиях (время А.),
- константы, зависящие от температуры. При равенстве скоростей А. и десорбции устанавливается
адсорбц. равновесие. Ср. продолжительность времени, к-рое частица находится
в адсорбир. состоянии в равновесных условиях (время А.), 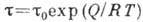 , где Q - теплота А., Л - универсальная газовая постоянная, Т - абс.
температуpa. Принято считать, что А. имеет место в том случае, когда
, где Q - теплота А., Л - универсальная газовая постоянная, Т - абс.
температуpa. Принято считать, что А. имеет место в том случае, когда 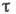 достигает величины неск. периодов колебаний адсорбир. молекулы - время, за к-рое
между ней и поверхностью успевает установиться энергетич. равновесие. Обычно
время физ. А. составляет 10-12-10-6 с, а время хемосорбции
- св. 102 с. Время А. служит критерием обратимости процесса А.
достигает величины неск. периодов колебаний адсорбир. молекулы - время, за к-рое
между ней и поверхностью успевает установиться энергетич. равновесие. Обычно
время физ. А. составляет 10-12-10-6 с, а время хемосорбции
- св. 102 с. Время А. служит критерием обратимости процесса А.
Теория А. Единая теория, к-рая описывала бы любые процессы А., пока не создана; существующие частные теоретич. разработки основываются на разл. моделях. Модель локализованной (или центровой) А. предполагает наличие на поверхности адсорбента т. н. центров А., представляющих собой либо строго определ. участки поверхности, на к-рых образуется сильная адсорбц. связь, либо распределённые по поверхности двумерные ячейки со слабым адсорбц. полем (полем сил межмолекулярного взаимодействия). В последнем случае предполагается наличие плотной упаковки молекул адсорбата на поверхности в пределах рассматриваемой ячейки.
В основе модели двумерной фазы лежит
положение о том, что адсорбир. монослой представляет собой неидеальный двумерный
газ, однако полимолекулярное покрытие поверхности адсорбента в данной модели
не рассматривается. И, наконец, потенциальная модель А. базируется на представлении
о потенц. поле поверхности твёрдого тела, в к-ром адсорбир. газ сжат вблизи
поверхности и разрежен в наружных слоях. Эти различные в своей основе модели
могут приводить к математически идентичным выражениям, хорошо согласующимся
с эксперим. данными. Полуэмпирич. теории, основанные
на рассмотренных моделях, не позволяют достаточно строго
интерпретировать эксперим. данные, т. к. пока не удаётся учитывать
энергетич. неоднородность поверхности, связанную с разл. природой
центров А. Осн. термодинамич. ур-нием, описывающим А., является ур-ние
Гиббса:
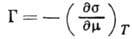
где 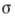 - поверхностное натяжение на границе раздела,
- поверхностное натяжение на границе раздела, 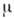 - химический потенциал
адсорбата. Ур-ние Гиббса можно использовать в качестве исходного для
вывода ур-ний А. при разл. условиях. К ним, в первую очередь, относятся
ур-ния изотерм А., представляющие собой зависимость кол-ва адсорбир.
вещества от давления р (или концентрации) адсорбата при пост. температуре.
- химический потенциал
адсорбата. Ур-ние Гиббса можно использовать в качестве исходного для
вывода ур-ний А. при разл. условиях. К ним, в первую очередь, относятся
ур-ния изотерм А., представляющие собой зависимость кол-ва адсорбир.
вещества от давления р (или концентрации) адсорбата при пост. температуре.
Теория Ленгмюра позволяет вывести ур-ние одной из наиб, простых изотерм
А., справедливое при строгой энергетич. однородности поверхности
адсорбента, а также при отсутствии на поверхности латерального
взаимодействия: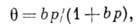
где b - константа, зависящая
от температуры и характера взаимодействия адсорбат - адсорбент. Типичный вид изотермы
Ленгмюра представлен кривой I на рис. 1. При низких значениях р, когда
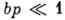 и
и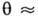
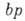 ,
изотерма Ленгмюра описывает А. в т. н. области Генри (см. Генри закон ).
,
изотерма Ленгмюра описывает А. в т. н. области Генри (см. Генри закон ).

Рис. 1. Наиболее часто встречающиеся изотермы адсорбции.
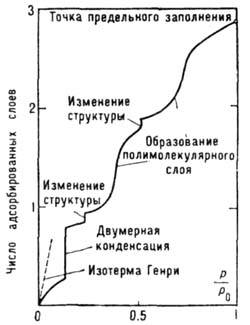
Рис. 2. Обобщённая изотерма адсорбции (изотерма Холси).
На рис. 1 это отражено прямолинейностью
нач. участка изотермы, совпадающего с прямой пунктирной линией. Теория Ленгмюра
применима к описанию монослойной физ. А. и хемосорбции, но лишь для огранич.
числа систем. Узкая область применимости теории Ленгмюра объясняется, по-видимому,
энергетич. неоднородностью поверхности, а также латеральным взаимодействием.
Последний фактор в наиб. простом приближении можно учесть путём введения в ур-ние
Ленгмюра вместо константы b константу
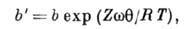
где Z - координационное число центров А. на поверхности, 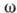 - энергия латерального взаимодействия двух адсорбир. молекул.
- энергия латерального взаимодействия двух адсорбир. молекул.
Модель Ленгмюра имеет достаточно общий
характер и служит основой для построения более развитых теорий, особенно хорошо
описывающих хемосорбцию. Так, если допустить, что распределение числа центров
А по энергии носит экспоненц. характер, можно получить ур-ние изотермы Фрейндлиха,
в большей степени, чем ур-ние Ленгмюра, применимое для описания процессов не
только хемосорбции, но и физ. А.: 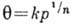 , где n>1 и k - постоянные. Использование экспериментально
полученной линейной зависимости теплоты А. от степени заполнения поверхности
при ср. значениях последней приводит к изотерме Шлыгина - Фрумкина для хемосорбции:
, где n>1 и k - постоянные. Использование экспериментально
полученной линейной зависимости теплоты А. от степени заполнения поверхности
при ср. значениях последней приводит к изотерме Шлыгина - Фрумкина для хемосорбции:
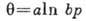 (а и b - константы).
(а и b - константы).
Вид наиб. часто встречающихся эксперим. типов изотерм (кривые II и III
на рис. 1) можно объяснить только на основе теорий, учитывающих
полимолекулярность физ. А, Из них наиб. часто применяемой является
теория Брунауэра - Эмметта - Теллера (БЭТ), основанная на локализованной
модели А. с центрами в виде двумерных ячеек и отсутствии латерального
взаимодействия. Её гл. положения - непостоянство толщины адсорбц. слоя
на разных участках поверхности и равенство теплот А. теплоте конденсации
адсорбата во всех слоях, начиная со второго. Ур-ние изотермы БЭТ имеет
вид
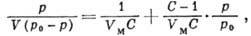
где 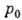 - давление насыщенного пара адсорбата, V - объём адсорбир. вещества, VM - ёмкость монослоя,
- давление насыщенного пара адсорбата, V - объём адсорбир. вещества, VM - ёмкость монослоя,
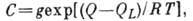
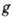 -
статистич. множитель (обычно
-
статистич. множитель (обычно 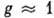 ),
), 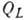 -
теплота конденсации адсорбата. При малых относит. давлениях
-
теплота конденсации адсорбата. При малых относит. давлениях 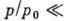 1 ур-ние БЭТ переходит в ур-ние Ленгмюра
1 ур-ние БЭТ переходит в ур-ние Ленгмюра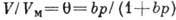
(где  ). Существуют модификации теории, применимые к пористым адсорбентам в
области капиллярной конденсации (кривая III). Теория БЭТ не учитывает
латерального взаимодействия, что является её существ. недостатком,
наряду с предположением о равенстве теплоты А. теплоте конденсации уже
во втором слое. На основе теории БЭТ получено большое число эмпирич.
ур-ний, позволяющих описать вид изотерм в нек-рых конкретных адсорбц.
системах, но не. являющихся универсальными.
). Существуют модификации теории, применимые к пористым адсорбентам в
области капиллярной конденсации (кривая III). Теория БЭТ не учитывает
латерального взаимодействия, что является её существ. недостатком,
наряду с предположением о равенстве теплоты А. теплоте конденсации уже
во втором слое. На основе теории БЭТ получено большое число эмпирич.
ур-ний, позволяющих описать вид изотерм в нек-рых конкретных адсорбц.
системах, но не. являющихся универсальными.
В потенц. теории А. (т. н. теория Поляни)
полагается, что А. протекает под действием не зависящего от температуры потенциала
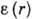 , численно равного
работе, совершаемой адсорбц. силами при переносе молекулы адсорбата из газовой
фазы в данную точку, находящуюся на расстоянии r от поверхности адсорбента;
при этом свободная энергия адсорбата увеличивается за
счёт сжатия последнего и
, численно равного
работе, совершаемой адсорбц. силами при переносе молекулы адсорбата из газовой
фазы в данную точку, находящуюся на расстоянии r от поверхности адсорбента;
при этом свободная энергия адсорбата увеличивается за
счёт сжатия последнего и 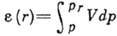 .
.
На основании потенц. модели можно для
каждой адсорбц. системы построить характеристическую кривую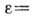
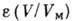 [в полимолекулярной области
[в полимолекулярной области 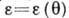 и характеристическая кривая может описывать энергетич. неоднородность поверхности];
с её помощью можно рассчитывать изотермы А. при разл. температурах, а также по изотерме
А. одного адсорбата рассчитать изотерму А. для другого.
и характеристическая кривая может описывать энергетич. неоднородность поверхности];
с её помощью можно рассчитывать изотермы А. при разл. температурах, а также по изотерме
А. одного адсорбата рассчитать изотерму А. для другого.
В теории, основанной на модели двумерной
фазы, вводят ур-ния состояния двумерного газа, аналогичные соответствующим ур-ниям
состояния газа в трёхмерном пространстве, напр. ур-ние состояния типа ур-ния
Менделеева - Клапейрона: 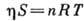 , где
, где 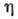 - давление
в двумерном слое, S - площадь поверхности, занятой адсорбатом, п - число молей адсорбир. вещества. На практике используют обычно одно из ур-ний
состояния реального газа и с его помощью выводят ур-ния, описывающие изотермы,
аналогичные изотерме I на рис. 1. Кроме того, теория А. на основе модели двумерной
фазы находится в определ. соответствии с потенц. моделью, если функция
- давление
в двумерном слое, S - площадь поверхности, занятой адсорбатом, п - число молей адсорбир. вещества. На практике используют обычно одно из ур-ний
состояния реального газа и с его помощью выводят ур-ния, описывающие изотермы,
аналогичные изотерме I на рис. 1. Кроме того, теория А. на основе модели двумерной
фазы находится в определ. соответствии с потенц. моделью, если функция 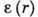 имеет вид прямоуг. потенц. ямы.
имеет вид прямоуг. потенц. ямы.
Плавная форма изотерм А., по-видимому, является следствием энергетич.
неоднородности поверхности. В то же время адсорбаты и их комплексы с
адсорбентами могут претерпевать на поверхности фазовые переходы,
проявляющиеся лишь в условиях строгой энергетич. однородности
поверхности в форме ступенек и изломов на эксперим. изотермах.
Обобщённая (модельная) изотерма Холси (рис. 2) отражает разл.
типы фазовых переходов, соответствующих как субмонослойной области, так и
области полимолекулярной А. Возможность всех подобных типов переходов
была подтверждена экспериментально.
Все перечисленные модели и теории относятся, в первую очередь, к А. на твёрдых адсорбентах из газовой фазы, однако с небольшими изменениями они пригодны и для описания А. из растворов.
Особое место занимает А. растворённого вещества на границе раздела
жидкость - воздух. Согласно ур-нию Гиббса, величина А. таких веществ
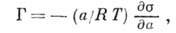
где а - активность растворённого вещества. Соединения, для к-рых 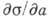 <0, т. е. Г>0, наз. поверхностно-активными веществами
(ПАВ); они характеризуются, как правило, полярностью более низкой, чем
полярность растворителя. А. ПАВ носит обычно характер монослойной физ.
А. и хорошо описывается теорией Ленгмюра.
<0, т. е. Г>0, наз. поверхностно-активными веществами
(ПАВ); они характеризуются, как правило, полярностью более низкой, чем
полярность растворителя. А. ПАВ носит обычно характер монослойной физ.
А. и хорошо описывается теорией Ленгмюра.
Помимо изотерм А., на практике часто пользуются изостерами А., выражающими зависимость между равновесным давлением и температурой А. для определ. кол-ва адсорбир. вещества. При помощи изостер, полученных методом термодесорбции, осуществляют обычно вычисление теплот А., к-рые можно определять также методом калориметрии. Для изучения А. в настоящее время применяется также разнообразный арсенал совр. методов исследования вещества. Для определения кол-ва адсорбир. вещества, числа адсорбц. центров и величины адсорбир. поверхности используют машинные методы анализа эксперим. изотерм, а также гравиметрич. и радиоизотопный методы и высокотемпературную газовую хроматографию.
Поверхность адсорбентов исследуют с
помощью методов рентгеновского структурного анализа и электронографии, оже-спектроскопии,
мёссбауэровской спектроскопии, рентгеновской и рентгеноэлектронной спектроскопии,
масс-спектроскопии, а также электронной микроскопии, мюонного и позитронного
методов. Для изучения молекул в адсорбир. состоянии используют флэш-десорбцию
(см. Десорбция ),все виды оптической и резонансной спектроскопии, дифракцию
медленных электронов, магн. методы, методы электронного или ионного проекторов,
а также всевозможные электро-хим. методы.
А. играет важную роль во мн. природных процессах, в первую очередь в
обогащении почв и образовании вторичных рудных месторождений. Явление А.
широко используется для разделения сложных газовых и жидких смесей
(хроматография), а также смесей электролитов (ионообменная
хроматография), в процессах крашения и протравливания, флотации и
стабилизации дисперсных систем. А. имеет важное значение в
гетерогенно-каталитич. хим. реакциях, во мн. биол. процессах - одним
словом везде, где существ. роль играют поверхностные явления.

А. X. Кероглу
|
|