Критическая точка - точка на диаграмме состояния веществ, соответствующая критическому состоянию,
в к-ром две (или более) фазы, находящиеся в термодинамич. равновесии, становятся
тождественными по своим свойствам. В частности, с приближением к критическому
состоянию различия в плотности, составе и др. свойствах сосуществующих фаз,
а также теплота фазового перехода и межфазное поверхностное натяжение уменьшаются,
а в К. т. равны нулю.

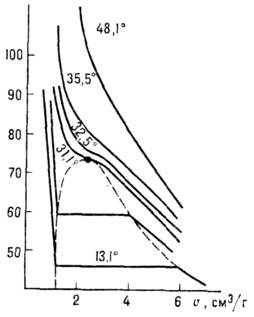
Рис. 1. Изотермы двуокиси
углерода для нескольких температур, р - давление, 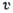 - удельный объём, К - критическая точка. Сплошные линии-изотермы, штриховые
- кривые сосуществования жидкости и газа.
- удельный объём, К - критическая точка. Сплошные линии-изотермы, штриховые
- кривые сосуществования жидкости и газа.
На диаграмме состояния
однокомпонентной системы существует лишь одна К. т. равновесия жидкость - газ,
характеризующаяся значениями критич. температуры Тс, критич. давления
рс, критич. удельного объёма 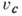 (см. табл. и рис. 1).
(см. табл. и рис. 1).
Критические параметры некоторых
веществ
|
|
Тс, К |
рс, МПа |
vf*106 м8/моль |
||
|
Гелий Не |
5, 19 |
0,227 |
57,4 |
||
|
Водород Н2 |
33,24 |
1,30 |
65,0 |
||
|
Неон Ne |
44,4 |
2,654 |
41,7 |
||
|
Азот N2 |
126,25 |
3,400 |
90, 1 |
||
|
Оксид углерода
СО |
132,93 |
3,499 |
93,0 |
||
|
Аргон Аr |
150,65 |
4,86 |
74,67 |
||
|
Кислород O2 |
154,58 |
5,043 |
78 |
||
|
Метан СН4 |
190,66 |
4,626 |
99,38 |
||
|
Криптон Кr |
209,39 |
5,49 |
91,9 |
||
|
Ксенон Хе |
289,74 |
5,83 |
118,29 |
||
|
Диоксид углерода
СО2 |
304, 13 |
7,375 |
94 , 04 |
||
|
Этан С2Н6 |
305,33 |
4,871 |
147, 1 |
||
|
Гексафторид серы
SF6 |
318,687 |
3,760 |
200, 1 |
||
|
Пропан С3Н8 |
369,85 |
4,247 |
200,0 |
||
|
Сероводород H2S |
373,6 |
9,007 |
97,4 |
||
|
Диоксид серы SO2 |
430,7 |
7,88 |
122 |
||
|
Триоксид серы SO3 |
491,4 |
8,49 |
126 |
||
|
Вода Н20 |
647,30 |
22, 12 |
56 |
||
|
Ртуть Hg |
1460 |
166, 1 |
48 |
||
|
Литий Li |
3200 |
68,9 |
66 |
||
При темп-pax выше Тс возможен непрерывный (без фазового превращения) переход вещества из газообразного
состояния в жидкое, поэтому К. т. является конечной точкой линии двухфазного
равновесия.
В К. т. соприкасаются линия
двухфазного равновесия (бинодаль) и граница термодинамич. устойчивости (спинодаль),
поэтому К. т. характеризуется условием В бинарных (двухкомпонентных)  растворах существуют линии К. т. (критич. кривые), при этом возможны не только
К. т. равновесия жидкость - газ (рис. 2), но и К. т. равновесия двух жидких
фаз (К. т. растворимости, рис. 3), двух газовых фаз (рис. 4) или двух твёрдых
фаз. Линии К. т. равновесия жидкость - газ начинаются и оканчиваются
в К. т. индивидуальных веществ. Чаще всего (в однокомпонентной системе всегда)
расслоение на две фазы происходит при понижении температуры. Однако в растворах
возможно существование нижних К. т. или даже одновременно нижних и верхних К.
т. (рис. 5). К. т. растворов дополнительно характеризуются критической концентрацией
хс. К. т. любого типа в бинарных растворах определяется условием
растворах существуют линии К. т. (критич. кривые), при этом возможны не только
К. т. равновесия жидкость - газ (рис. 2), но и К. т. равновесия двух жидких
фаз (К. т. растворимости, рис. 3), двух газовых фаз (рис. 4) или двух твёрдых
фаз. Линии К. т. равновесия жидкость - газ начинаются и оканчиваются
в К. т. индивидуальных веществ. Чаще всего (в однокомпонентной системе всегда)
расслоение на две фазы происходит при понижении температуры. Однако в растворах
возможно существование нижних К. т. или даже одновременно нижних и верхних К.
т. (рис. 5). К. т. растворов дополнительно характеризуются критической концентрацией
хс. К. т. любого типа в бинарных растворах определяется условием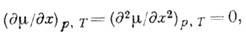 где
где  - разность хим. потенциалов компонентов раствора, х - концентрация одного
из компонентов. Линии К. т. равновесия жидкость - жидкость и газ - газ обычно
пересекаются с линиями др. фазовых равновесий. При этом К. т. равновесия двух
фаз в присутствии третьей (некритич. фазы) наз. конечной критич. точкой. В многокомпонентных
растворах (3 и более компонентов) существуют линии конечных К. т. В точке, где
сливаются линии конечных К. т. равновесия жидкость - жидкость (в присутствии
некритич. газовой фазы) и равновесия жидкость - газ (в присутствии некритич.
жидкой фазы), становятся тождественными
3 фазы. Такая точка наз. трикритической. Возможно существование точек высш.
порядка (поликритических), в к-рых становятся тождественными 4 фазы и более.
- разность хим. потенциалов компонентов раствора, х - концентрация одного
из компонентов. Линии К. т. равновесия жидкость - жидкость и газ - газ обычно
пересекаются с линиями др. фазовых равновесий. При этом К. т. равновесия двух
фаз в присутствии третьей (некритич. фазы) наз. конечной критич. точкой. В многокомпонентных
растворах (3 и более компонентов) существуют линии конечных К. т. В точке, где
сливаются линии конечных К. т. равновесия жидкость - жидкость (в присутствии
некритич. газовой фазы) и равновесия жидкость - газ (в присутствии некритич.
жидкой фазы), становятся тождественными
3 фазы. Такая точка наз. трикритической. Возможно существование точек высш.
порядка (поликритических), в к-рых становятся тождественными 4 фазы и более.
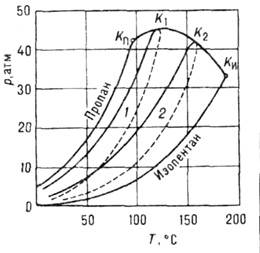
Рис. 2. Кривые равновесия
жидкость -пар и критическая
кривая системы пропан- изопентан; 1, 2 - кривые жидкости (сплошные) и
пара (пунктирные) для смесей с мольной долей изопентана 0,206 и 0,607; Кп,
КИ - критические точки пропана и изопентана, K1,2
- критические точки этих смесей.
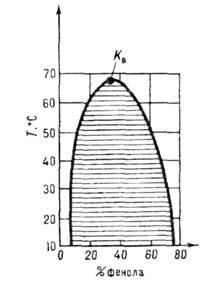
Рис. 3. Кривая расслоения
на две фазы жидкого раствора вода - фенол при р = const, KB - верхняя критическая точка. Заштрихована область двухфазного равновесия.
Рис. 4. Кривые фазового
равновесия газ - газ в системе азот - аммиак при высоких давлениях, Кi - критические точки
Переход системы из однофазного состояния в двухфазное вне К. т. и изменение состояния в самой К. т. существенно различаются. В первом случае при расслаивании на две фазы переход начинается с появлением небольшого кол-ва (зародыша) 2-й фазы, свойства к-рой отличаются от свойств 1-й фазы, что сопровождается выделением или поглощением теплоты фазового перехода. Поскольку возникновение зародыша новой фазы приводит к появлению поверхности раздела фаз и поверхностной энергии, для его рождения требуется определ. энергия. Это означает, что такой фазовый переход (1-го рода) может начаться лишь при нек-ром переохлаждении (перегреве) вещества, способствующем появлению устойчивых зародышей новой фазы (см. Кинетика фазовых переходов).
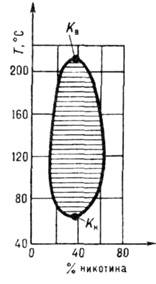
Рис. 5. В двухкомпонентной
жидкой системе никотин - вода имеются верхняя критическая точка растворения
Кв и нижняя Кн; заштрихована
область двухфазного равновесия.
К. т. обнаруживает глубокую
аналогию с точками фазовых переходов 2-го рода: в К. т. фазовый переход происходит
в масштабах всей системы, а свойства флуктуационно возникающей новой фазы бесконечно
мало отличаются от свойств исходной фазы. Поэтому возникновение новой фазы не
связано с поверхностной энергией, т. е. исключается перегрев (переохлаждение),
и фазовый переход не сопровождается выделением или поглощением теплоты, что
характерно для фазовых переходов 2-го рода. Как и вблизи фазовых переходов 2-го
рода, вблизи К. т. наблюдается ряд особенностей в поведении физ. свойств, обусловленных
аномальным ростом флуктуации.

М. А. Анисимов
Вещество и поле не есть что-то отдельное от эфира, также как и человеческое тело не есть что-то отдельное от атомов и молекул его составляющих. Оно и есть эти атомы и молекулы, собранные в определенном порядке. Также и вещество не есть что-то отдельное от элементарных частиц, а оно состоит из них как базовой материи. Также и элементарные частицы состоят из частиц эфира как базовой материи нижнего уровня. Таким образом, всё, что есть во вселенной - это есть эфир. Эфира 100%. Из него состоят элементарные частицы, а из них всё остальное. Подробнее читайте в FAQ по эфирной физике.
|
|