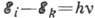 , где
, где 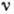 - частота
поглощаемого или испускаемого монохрома-тич. эл--магн. излучения,
- частота
поглощаемого или испускаемого монохрома-тич. эл--магн. излучения, 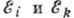 - энергии стационарных состояний, между к-рыми происходит переход.
- энергии стационарных состояний, между к-рыми происходит переход.Атомная физика - раздел физики, посвящённый изучению строения и свойств атомов и элементарным процессам, в к-рых участвуют атомы. Наиб. характерные для А. ф. длины (линейные размеры атомов) ~10-8 см, а энергии (энергии связи внеш. электронов в атоме, элементарных хим. процессов с участием атомов) порядка эВ (тогда как для ядерной физики наиб. характерны длины ~10-13 см и энергии порядка МэВ; см. Атом, Атомные спектры, Рентгеновские спектры. Поляризуемость атомов, ионов и молекул, Спонтанное испускание, Вынужденное испускание, Эйнштейна коэффициенты, Фотоэффект, Столкновения атомные. Низкотемпературная плазма).
Теоретич. основа А. ф.- квантовая теория
(см. Квантовая механика, Квантовая алектродинамика), позволяющая объяснить
огромную совокупность микроскопич. явлений на атомно-молекулярном уровне. Существенно,
что строение и свойства атома как системы, состоящей из ядра и электронов, и
характеристики излучательных и безызлучательных элементарных процессов, протекающих
на этом уровне, определяются эл--магн. взаимодействием (в отличие от ядерной
физики и физики элементарных частиц, в к-рых фундам. роль играют сильное
взаимодействие и слабое взаимодействием; причём сильное взаимодействие
не проявляется на характерных для А. ф. расстояниях, превышающих 10-12
см, а слабое взаимодействие должно приводить в А. ф. к весьма интересным, но
очень малым по величине эффектам).
Предыстория и основные этапы развития атомной физики. Возникновению А. ф. предшествовало развитие атомистич. представлений о строении материи. Первонач. идеи о существовании атомов как мельчайших неделимых и неизменных частиц материи были высказаны в Древней Греции в 5-3 вв. до н. э. (Демокрит, Эпикур). В период становления точного естествознания в 17-18 вв. атомистич. представления в разл. формах развивали И. Кеплер (J. Kepler), П. Гассенди (P. Gassendi), P. Декарт (R. Descartes), P. Бойль (R. Boyle), И. Ньютон (I. Newton), M. В. Ломоносов, P. Бошкович (R. Boskovic) и др. Однако эти представления носили гипотетич. характер и лишь с кон. 18 - нач. 19 вв. эксперим. исследования свойств вещества привели к созданию атомистич. теорий.
На основе установленных количественных
хим. законов и законов идеальных газов с начала 19 в. стала развиваться химическая
атомистика [Дж. Дальтон (J. Dalton), А. Авогадро (A. Avogadro di Quaregna),
Я. Берцелиус (J. Berzelius)], в сер. 19 в. чётко разграничены и определены понятия
атома и молекулы [С. Канниццаро (S.
Cannizzaro)], в 1869 Д. И. Менделеев открыл периодич. закон хим. элементов (см.
Периодическая система элементов). Представления физической атомистики
легли в основу развития молекулярной физики, в т. ч. кинетич. теории газов (сер.
19 в.), и классич. статистической физики [2-я пол. 19 в., P. Клаузиус
(R. Clausius), Дж. Максвелл (J. С. Maxwell), Л. Больцман (L. Boltzmann), Дж.
У. Гиббс (J. W. Gibbs)]. B кон. 18-19 вв. начало развиваться учение о внутр.
строении кристаллов и их симметрии [P. Гаюи (R. J. Hauy), O. Браве (A. Bravais),
E. С. Фёдоров, А. Шёнфлис (A. M. Schoenflies)] на основе атомистич. представлений
(см. Симметрия кристаллов, Враве решетки). Однако в 19 в. хим и физ.
атомистика и атомистика в кристаллографии не имели общей теоретич. основы, ею
стала в 20 в. квантовая теория строения атомов, молекул и кристаллов, созданная
в результате развития А. ф.
Возникновение современной атомной физики связано с открытиями электрона (1897) и радиоактивности (1896). Они создали основу для построения моделей атома как системы взаимодействующих электрически заряженных частиц. Важнейшим этапом развития атомной физики стало открытие Э. Резерфордом (E. Rutherford) в 1911 атомного ядра и рассмотрение атома на основе квантовых представлений H. Бором (N.H.D. Bohr) в 1913. Резерфорд предложил модель атома, состоящего из центрального положительно заряж. ядра большой массы и размеров, малых по сравнению с размерами атома в целом, и из отрицательно заряженных электронов, имеющих по сравнению с ядром малую массу. Он экспериментально обосновал эту модель опытами по рассеянию a-частиц атомами. Все свойства атома оказались связанными либо со свойствами ядра (их изучает ядерная физика), либо со свойствами электронных оболочек атома.
Строение последних определяет химические
и большинство физ. свойств атома и периодичность этих свойств в зависимости
от осн. характеристики атома в целом - величины положит. заряда его ядра. Однако
на основе законов классич. физики не могли быть объяснены устойчивость атома
(ускоренно движущиеся вокруг ядра электроны должны непрерывно излучать и очень
быстро упасть на ядро) и линейчатые атомные спектры, закономерности в к-рых
подчиняются комбинац. принципу Ритца. Выход из этих трудностей нашёл Бор, применив
к атому квантовые представления, впервые введённые M. Планком в 1900 и развивавшиеся
с 1905 А. Эйнштейном и др. учёными. Основу квантовой теории атома Бора составляют
два постулата: 1-й постулат Бора о существовании стационарных состояний атома,
находясь в к-рых он не излучает (стационарные состояния обладают опре-дел. значениями
энергии, в общем случае дискретными, из одного состояния в другое атом может
переходить путём квантового, скачкообразного, перехода), 2-й постулат Бора о
квантовых переходах с излучением, определяемых условием частот: 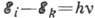 , где
, где 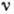 - частота
поглощаемого или испускаемого монохрома-тич. эл--магн. излучения,
- частота
поглощаемого или испускаемого монохрома-тич. эл--магн. излучения, 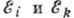 - энергии стационарных состояний, между к-рыми происходит переход.
- энергии стационарных состояний, между к-рыми происходит переход.
Постулаты Бора были всесторонне подтверждены экспериментально, оказались применимыми для др. микросистем (молекул, атомных ядер) и получили тео-ретич. обоснование в квантовой механике и квантовой электродинамике. Для определения возможных дискретных значений энергии простейшего атома - атома водорода - в стационарных состояниях Бор применил классич. механику и предположение о совпадении результатов квантовой и классич. теорий при малых частотах излучения, что представляло первонач. форму соответствия принципа ,к-рый Бор развивал в дальнейшем, придавая ему большое значение; принцип соответствия сыграл большую роль в становлении квантовой механики.
Рассмотрение, согласно модельной теории атома Бора, движения электронов в
стационарных состояниях по законам классической механики при дополнительных
условиях квантования (в частности, при условии равенства момента импульса электрона на круговой орбите
целому кратному постоянной 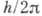 ;
это условие часто неправильно включают в число постулатов Бора) позволило самому Бору, А. Зоммерфельду (A. Sommerfeld) и др. учёным объяснить закономерности
в оптич. и рентгеновских спектрах и дать физ. истолкование периодич. закона элементов. Однако модельная теория Бора встретилась с рядом трудностей при объяснении
свойств сложных атомов и простейших молекул (уже для атома гелия и молекулы водорода), что было связано с использованием классич. механики и имело принципиальный
характер. Эти трудности были разрешены на следующем этапе развития А. ф. созданием начиная с 1925 последоват. квантовой теории.
;
это условие часто неправильно включают в число постулатов Бора) позволило самому Бору, А. Зоммерфельду (A. Sommerfeld) и др. учёным объяснить закономерности
в оптич. и рентгеновских спектрах и дать физ. истолкование периодич. закона элементов. Однако модельная теория Бора встретилась с рядом трудностей при объяснении
свойств сложных атомов и простейших молекул (уже для атома гелия и молекулы водорода), что было связано с использованием классич. механики и имело принципиальный
характер. Эти трудности были разрешены на следующем этапе развития А. ф. созданием начиная с 1925 последоват. квантовой теории.

M. А. Елъяшевич
|
|