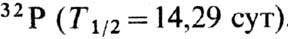
Фосфор, Phosphorus, P - от греч. phosphoros, букв.- светоносный), Р-хим. элемент V группы периодич.
системы элементов, ат. номер 15, ат. масса 30,97376. В природе представлен одним
31Р. Конфигурация внеш. электронных оболочек 3s2p3. Энергии последоват. ионизации 10,486; 19,76; 30,16; 51,36 и 65,02 эВ. Сродство
к электрону 0,8 эВ. Радиус атома Р 134, ионов Р3-, Р3+
и Р5+ соответственно 186; 44 и 35 пм. Значение электроотрицательности
2,1.
Ф.- типичный неметалл.
Известно неск. его аллотропных модификаций, наиб. важны белый (его иногда наз.
жёлтым), красный и чёрный Ф. При условиях, близких к нормальным, стабилен чёрный
Ф., однако в этих условиях довольно длит. время могут существовать белый и красный
Ф. (вследствие низкой скорости фазовых переходов).
Белый Ф. состоит из молекул
Р4. При темп-pax выше - 76,9 °С устойчива a-модификация белого
Ф. с параметром кубич. решётки а= 1,851 нм, а при более низких темп-pax
и давлениях 12 ГПа и выше устойчива b-модификация с параметром кубич. решётки
а = 0,2377 нм. При нагревании без доступа воздуха до 250-300 °С белый
Ф. превращается в полимерный красный Ф. (цвет варьирует от алого до кирпичного
в зависимости от условий перехода). Можно получить и кристаллич. красный Ф.,
напр. его кристаллизацией из расплава в свинце (т. н. фосфор Гитторфа). При
200-220 °С и давлениях 1,2-1,7 ГПа белый Ф. переходит в чёрный, имеющий
ромбич. решётку с параметрами а = 331 пм, b= 438 пм и с= 1050 пм. Структура чёрного Ф. напоминает слоистую структуру графита. Белый
и красный Ф--диэлектрики, чёрный-полупроводник (при 25 °С ширина запрещённой
зоны 0,33 эВ).
Белый Ф. (a-модификация)-серое
или жёлтое воско-образное вещество, к-рое люминесцирует в процессе медленного
окисления на воздухе (светится в темноте). Плотн. 1,828 кг/дм3, tпл
= 44,14°С, tкип = 257 °С (по др. данным, 280,5 °С).
Уд. теплоёмкость ср = 23, 8 Дж/(моль.К), теплота
плавления 0,66 кДж/моль. Уд. электрич. сопротивление белого Ф. 1540 МОм.м.
Диамагнитен, магн. восприимчивость c=-0,86.10-9 . Белый
Ф. самовоспламеняется при 44 °С; при его горении образуется густой белый
дым, а сам Ф. разбрызгивается. Поэтому его хранят под слоем воды (в воде он
не растворяется, хорошо растворим в сероуглероде, слабо - в спирте, бензоле
и др.).
Плотность красного Ф. 2,0-2,4
кг/дм3. При обычных давлениях и нагревании не плавится, а сублимирует
(в газовой фазе состоит из молекул Р4); при давлениях в неск. МПа
и температурах 585-610 °С плавится. Красный Ф. нерастворим в воде и органич.
растворителях. Плотность чёрного
Ф. 2,70 кг/дм3, его уд. электрич. сопротивление 15 МОм.м.
Химически наиболее активен
белый Ф., красный и особенно чёрный Ф. имеют низкую хим. активность. Ф. обычно
проявляет степени окисления -3, +3 и +5 (наиб. устойчива). При окислении на
воздухе образуется белый снегообразный оксид Р2О5, являющийся
хорошим влаго-поглотителем. Со мн. металлами Ф. образует фосфиды. Входит в состав
мн. биологически важных соединений (АТФ, аденозинтрифосфорной к-ты, фосфопротеинов
и др.).
Ф. используют для легирования
сталей. Фосфиды индия, галлия и др.- полупроводниковые материалы. Красный Ф.
неядовит (применяется в производстве спичек и для др. целей), белый Ф.- высокотоксичен.
Для удаления остатков белого Ф. используют водный раствор медного купороса СuSO
4. В качестве радиоакт. индикатора применяют b--радиоактивный

С. С. Бердоносов.
|
|