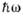
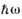 - -> CO3- + H2O
- -> CO3- + H2OОтрицательные ионы в газах - атомы или молекулы газа, захватившие добавочный электрон.
Атомный О. и. представляет собой
связанное состояние атома и электрона; по своей структуре как система,
состоящая из положительно заряженного ядра и электронов, О. и. подобен
атому. Однако, в отличие от атома, в О. и. взаимодействие валентного электрона
с атомом короткодействующее; поэтому число связанных состояний О. и. чаще
всего одно, в то время как атом обладает бесконечным числом связанных состояний.
Взаимодействие валентного электрона О. и. с атомным остатком носит
обменный характер (см. (Обменное взаимодействие ).Поэтому способностью
присоединять к электронной оболочке добавочный электрон обладают атомы,
у к-рых внеш. часть этой оболочки не заполнена. Для атома с заполненной
электронной оболочкой взаимодействие имеет характер отталкивания; вследствие
этого щёлочноземельные металлы, имеющие заполненную внеш. s-оболочку
из двух электронов, и инертные газы, имеющие замкнутую оболочку из шести
р-электронов,
не имеют О. и.
Осн. характеристикой О. и. является энергия
связи электрона и захватившего его атома, наз. энергией
сродства к электрону и обозначаемая ЕА (electron affinity).
ЕА значительно
меньше потенциалов ионизации атомов (табл. 1).
Методов измерения ЕА существует
много. Наиб. информация получена методом фотоэлектронной спектроскопии
- измерение порога фотораспада О. и. или энергии электронов, оторванных
от О. п. при облучении лазерным излучением. ЕА для атомов галогенов
определяются по спектру излучения плазмы, к-рый даёт порог фотоприлипания
электрона к атому галогена. Др. методы: метод поверхностной ионизации,
анализ диссоциативного прилипания электрона к молекуле - обеспечивают точность,
на два порядка худшую, чем метод фотоэлектронной спектроскопии.
Табл. 1. - Энергия связи различных атомов
и электрона
|
Атом
|
EA, эB
|
Атом
|
ЕА, эB
|
|||
|
1
|
Н
|
0,75416
|
37
|
Rb
|
0,4859
|
|
|
3
|
Li
|
0,609
|
39
|
Y
|
0,307
|
|
|
5
|
В
|
0,277
|
40
|
Zr
|
0,426
|
|
|
6
|
С
|
1,269
|
41
|
Nb
|
0,893
|
|
|
7
|
N
|
нет
|
42
|
Mo
|
0,746
|
|
|
8
|
О
|
1,46112
|
43
|
Tc
|
0,5
|
|
|
9
|
F
|
3,399
|
44
|
Ru
|
1 ,05
|
|
|
11
|
Na
|
0,5479
|
45
|
Rh
|
1, 137
|
|
|
13
|
Al
|
0,441
|
46
|
Pd
|
0,557
|
|
|
14
|
Si
|
1,385
|
47
|
Ag
|
1 ,302
|
|
|
15
|
Р
|
0,7465
|
49
|
In
|
0,3
|
|
|
16
|
S
|
2,07712
|
50
|
Sn
|
1,2
|
|
|
17
|
Cl
|
3,617
|
51
|
Sb
|
1,07
|
|
|
19
|
К
|
0 ,501
|
52
|
Те
|
1,9708
|
|
|
21
|
Sc
|
0,188
|
53
|
I
|
3,0591
|
|
|
22
|
Ti
|
0,079
|
55
|
Cs
|
0,47163
|
|
|
23
|
V
|
0,525
|
57
|
La
|
0,5
|
|
|
24
|
Сr
|
0,666
|
73
|
Та
|
0,322
|
|
|
25
|
Mn
|
нет
|
74
|
W
|
0,815
|
|
|
26
|
Fe
|
0,163
|
75
|
Re
|
0,15
|
|
|
27
|
Co
|
0,061
|
76
|
Os
|
1,14
|
|
|
28
|
Ni
|
1,156
|
77
|
Ir
|
1,56
|
|
|
29
|
Cu
|
1 ,228
|
78
|
Pt
|
2,128
|
|
|
31
|
Ga
|
0,30
|
79
|
Au
|
2,3086
|
|
|
32
|
Ge
|
1,20
|
81
|
Tl
|
0,2
|
|
|
33
|
As
|
0,81
|
82
|
Pb
|
0,364
|
|
|
34
|
Sе
|
2,0207
|
83
|
Bi
|
0,946
|
|
|
35
|
Br
|
3,365
|
84
|
Po
|
1,9
|
Примечание. Несуществующие отрицательные ноны инертных газов и щёлочноземельных металлов не включены в таблицу.
Двухзарядиые О. и. не существуют. В редких случаях О. и. могут иметь метастабильные возбуждённые состояния. В табл. 2 приводятся ЕА для основного и возбуждённого состояний тех О. и., у к-рых имеются возбуждённые состояния.
Табл. 2. - Энергия связи в основном
и возбуждённом состояниях
|
Отрицательный
ион, состояние
|
EA,эВ
|
|
C-(4S)
|
1,269
|
|
C-(2D)
|
0,033
|
|
Аl-(3P)
|
0,441
|
|
Al-(2D)
|
0,109
|
|
Si-(4S)
|
1,385
|
|
Si-(2D)
|
0,523
|
|
Si-(2P)
|
0,029
|
|
Se-(1D)
|
0,188
|
|
Se-(3D)
|
0,041
|
|
Отрицательный
ион, состояние
|
EA, эВ
|
|
Ge-(4S)
|
1 ,2
|
|
Ge-(2D)
|
0,4
|
|
Y-(1D)
|
0,307
|
|
Y-(3D)
|
0,164
|
|
Pd-
(2S)
|
0,557
|
|
Pd-(2D)
|
0,421
|
|
Sn-(4S)
|
1,2
|
|
Sn-(2D)
|
0,4
|
Если О. и. содержит два возбуждённых электрона, то такое состояние является автораспадным. Короткоживущие (~ 10-4с) автораспадные состояния О. л. проявляются в процессах столкновения электронов с атомами. Напр., существование автораспадного состояния О. и. азота повышает эффективность излучения низкотемпературной азотной плазмы.
Молекулярные О. и. представляют собой связанное состояние молекулы и электрона. Энергии сродства нек-рых молекул к электрону приведены в табл. 3.
Табл. 3. - Энергия связи электрона с
молекулой
|
Молекула
|
ЕА, эВ
|
Молекула
|
ЕА, эВ
|
|
|
Br2
|
2,6
|
NO2
|
3,1
|
|
|
Cl2
|
2,4
|
O3
|
2,1
|
|
|
F2
|
3,0
|
SH2
|
1,1
|
|
|
I2
|
2,5
|
SO2
|
1,0
|
|
|
O2
|
0,44
|
СО3
|
2,8
|
|
|
OН
|
1,83
|
NO2
|
3,7
|
|
|
S2
|
1,66
|
СО4
|
1,2
|
Методы определения ЕА для молекулярных
отрицательных ионов основаны на исследовании поверхностной ионизации, процессов фотораспада,
диссоциативного прилипания и др. ионно-молекуляр-ных и ионно-ионых процессов.
Точность определения ЕА для молекул существенно ниже, чем для атомов.
Молекулярные О. п. могут образовывать кластерные ионы; особенно
эффективно они образуются в электроотрицат. газах при низких темп-pax.
Наличие автораспадных состояний молекулярных О. и. увеличивает эффективность
ко лебательного возбуждения молекул в разряде на неск. порядков.
Процессы разрушения и образования О. и.
очень разнообразны (табл. 4).
Табл. 4. - Разрушение и образование
отрицательных ионов
|
Процесс
|
Пример
|
|
1. Диссоциативное
прилипание электрона к молекуле
|
е + Н2 -->
H- + Н
|
|
2. Прилипание
электрона к молекуле при тройных столкновениях
|
е+ 2 О2
--> О2- + О2
|
|
3. Радиац. прилипание
электрона к атому и молекуле
|
е + Н -->
H- +
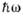 |
|
4. Хемнпонизация
|
Cs + MoF6
- -> Cs+ + MoF6
|
|
5. Резонансная
перезарядка
|
H-
+ H - -> H + H-
|
|
6. Нерезонансная
перезарядка
|
О2-
+ О3- ->O2 + O3-
|
|
7. Ионно-молекулярные
реакции
|
UF6-+ BF3 - -> UF5 + BF4-
|
|
8. Образование
кластерных ионов
|
OH-+H20+O2
- -> ОН- * H2O+O2
|
|
9. Фотодиссоциация
|
CO3-
х
H2O +
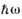 - -> CO3- + H2O - -> CO3- + H2O |
|
10. Фотораспад
|
H-
+
hw - ->
H + e
|
|
11 . Взаимная
нейтрализация ионов
|
H+
+ H- - ->2H
|
|
12. Рекомбинация
ионов при тройных столкновениях
|
NO
++NO2-+N2
- -> NO+NO2+N2
|
|
13. Ассоциативный
распад
|
O-
+ СО - -> СО2 + e
|
|
14. Разрушение
О. и. при столкновениях
|
H-
+ He - -> H + He + e
|
Эффективностью этих процессов определяется роль отрицательных ионов в разл. газово-плазменных системах. Образование О. и. в газовом разряде резко снижает проводимость плазмы, а это приводит к возникновению неустойчивостей и структур в газовом разряде. Введение в газовый промежуток электроотрицат. газов повышает его пробойное напряжение. Существенны процессы с О. и. в атмосфере Земли, планет, звёзд. Отрицат. заряд у поверхности Земли связан с процессом 2 (табл. 4). Излучение Солнца в оптич. области спектра в большей степени создаётся процессом 3 (табл. 4), протекающим в фотосфере Солнца.

Б. М. Смирнов
|
|