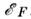 ,ас ней ср.
кинетич. энергия электронов
,ас ней ср.
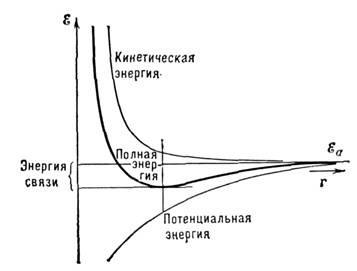
кинетич. энергия электронов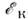 Равновесная плотность электронов соответствует минимуму полной энергии. Расстояние
между ионами, при к-ром это условие реализуется, можно считать атомным радиусом
металла (рис.).
Равновесная плотность электронов соответствует минимуму полной энергии. Расстояние
между ионами, при к-ром это условие реализуется, можно считать атомным радиусом
металла (рис.).Металлическая связь - разновидность гомо-полярной химической связи, реализующаяся в металлах и сплавах. При сближении атомов и образовании
кристаллов металлов и сплавов волновые функции валентных электронов перекрываются.
Поэтому представление о локализации внеш. электронов вблизи атома теряет смысл.
Это соответствует классич. представлениям о наличии в металлах "газа"
свободных электронов (см. Друде теория металлов ).Отрицательно заряженный
электронный газ удерживает положительно заряженные ионы металла на определённых
расстояниях друг от друга.
В действительности M. с. имеет более сложную
природу, и методы её расчёта основаны на зонной теории твёрдого тела.
В наиб, простом варианте характер M. с. определяется двумя факторами. С одной
стороны, при сближении металлич. атомов волновые функции электронов перекрываются
и электрон имеет возможность перемещаться в более широкой области пространства
(чем в изолированном атоме), где он имеет более низкую потенциальную энергию.
С др. стороны, при "сжатии" электронного газа возрастает энергия
Ферми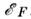 ,ас ней ср.
кинетич. энергия электронов
,ас ней ср.
кинетич. энергия электронов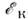 Равновесная плотность электронов соответствует минимуму полной энергии. Расстояние
между ионами, при к-ром это условие реализуется, можно считать атомным радиусом
металла (рис.).
Равновесная плотность электронов соответствует минимуму полной энергии. Расстояние
между ионами, при к-ром это условие реализуется, можно считать атомным радиусом
металла (рис.).
Чистая ненаправленная M. с. наблюдается у одновалентных
металлов (Na, Li и др.), обладающих кубическими плотно упакованными структурами.
В случае металлов с неск. электронами на внеш. оболочке характер взаимодействия
усложняется, поскольку не все электроны делокализуются. Поэтому определённую
составляющую в связь вносит ковалентное взаимодействие (см. Ковалентная связь). Эти металлы имеют кубическую объёмно-центриров. структуру или гексагональную
плотную упаковку атомов.
Металлическая связь определяет электрич. и тепловые свойства
металлов, обусловливая высокие электро- и теплопроводности. Характер M. с. сказывается
и на механич. свойствах металлов. Металлы - наиб, пластичные кристаллы, т. к.
в них возможно свободное перемещение дислокации:  уменьшается, если расстояние между ионами растёт. Соответственно энергия связи
зависит гл. обр. от плотности упаковки атомов и система легко приспосабливается
к локальным отклонениям от строгой регулярности решётки.
уменьшается, если расстояние между ионами растёт. Соответственно энергия связи
зависит гл. обр. от плотности упаковки атомов и система легко приспосабливается
к локальным отклонениям от строгой регулярности решётки.

Вещество и поле не есть что-то отдельное от эфира, также как и человеческое тело не есть что-то отдельное от атомов и молекул его составляющих. Оно и есть эти атомы и молекулы, собранные в определенном порядке. Также и вещество не есть что-то отдельное от элементарных частиц, а оно состоит из них как базовой материи. Также и элементарные частицы состоят из частиц эфира как базовой материи нижнего уровня. Таким образом, всё, что есть во вселенной - это есть эфир. Эфира 100%. Из него состоят элементарные частицы, а из них всё остальное. Подробнее читайте в FAQ по эфирной физике.
|
|