 O2+O.
O2+O.Кислород (Oxygenium), O,- хим. элемент VI группы периодич. системы элементов, ат. номер 8, ат. масса
15,9994 а. е. м. Природный К. состоит из трёх стабильных изотопов: 16О(99,762%),17О
(0,038%) и 18O (0,200%). Ядра атомов 16О содержат 8 протонов
и 8 нейтронов и обладают особой устойчивостью; они являются самыми распространёнными
ядрами земной коры. Тетраэдрич. атомный радиус К. (при координац. числе 4) равен
0,066 нм, октаэдрич. (координац. число 6) 0,074 нм, радиус иона О2-
0,136 нм. Электронная конфигурация внеш. оболочки 2s2p4.
Энергии последоват. ионизации 13,618, 35,117 и 54,90 эВ. Сродство к электрону
1,467 эВ. Значение электроотрицательности 3,50.
К. существует в виде двух
простых веществ: собственно К. с молекулой O2 и озона O3,
к-рый образуется, напр., в электрич. разрядах в атмосфере. Молекулы О2
достаточно устойчивы, энергия их диссоциации 493,6 кДж/моль (при 0 К), межъядерное
расстояние 0,120735 нм. Энергия ионизации молекулы O2 12,2 эВ, сродство
к электрону 0,94 эВ. В молекуле О3 межъядерное расстояние 0,12717
нм, валентный угол О-О-О 116,78°. Озон неустойчив и легко распадается О, O2+O.
O2+O.
К. O2 - бесцветный
газ без запаха и вкуса; озон О3 обладает синей окраской и имеет резкий
запах. К. О2 при О °С имеет теплоёмкость ср=29,27
Дж/мольК, cV=20,5 Дж/мольК, tкип = -192,98°С,
tпл = -218,7°С. Твёрдый К. при температуре ниже -249,3 °С
имеет ромбич. кристаллич. решётку (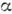 -О,
синие кристаллы), при температуре -249,3 °С переходит в
-О,
синие кристаллы), при температуре -249,3 °С переходит в 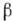 -О
с ромбоэдрич. кристаллич. решёткой. При температуре выше -229,4 °С существует
-О
с ромбоэдрич. кристаллич. решёткой. При температуре выше -229,4 °С существует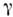 -О
с кубич. кристаллич. решёткой. Плотность газообразного К. 1,42897 кг/м3
(при О °С и нормальном давлении), жидкого - 1,1321 кг/дм3 (при
tкип), твёрдого -1,46 кг/дм3 (при -252,7 °С).
Кри-тич. темп-pa - 118,84 °С, критич. давление 4,97 МПа, теплота испарения
6,82 кДж/моль, теплота плавления 0,443 кДж/моль. При 0 °С теплопроводность
24мВт/м-К, диэлектрич. проницаемость 1,000547, вязкость 18,9 мкПа-с. Парамагнитен,
магн. восприимчивость
-О
с кубич. кристаллич. решёткой. Плотность газообразного К. 1,42897 кг/м3
(при О °С и нормальном давлении), жидкого - 1,1321 кг/дм3 (при
tкип), твёрдого -1,46 кг/дм3 (при -252,7 °С).
Кри-тич. темп-pa - 118,84 °С, критич. давление 4,97 МПа, теплота испарения
6,82 кДж/моль, теплота плавления 0,443 кДж/моль. При 0 °С теплопроводность
24мВт/м-К, диэлектрич. проницаемость 1,000547, вязкость 18,9 мкПа-с. Парамагнитен,
магн. восприимчивость 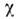 =
107,8-10-9 (при 20°С). Растворимость К. в 1м3 воды
при нормальном давлении 0,031 м3 (20 °С) и 0,049 м3(0°С).
=
107,8-10-9 (при 20°С). Растворимость К. в 1м3 воды
при нормальном давлении 0,031 м3 (20 °С) и 0,049 м3(0°С).
В соединениях К. проявляет
степень окисления -2, реже -1. Обладает высокой реакц. способностью (хим. активность
О3 выше, чем O2) и образует соединения почти со всеми
хим. элементами. Бинарные соединения, в к-рых атомы К. не связаны между собой,
наз. оксидами (CaO, SO2 и др.). Соединения, содержащие группировку
О-О, наз. пероксидами (напр., пероксид водорода Н2O2).
Хим. реакции с участием К. (реакции окисления) обычно сопровождаются выделением
большого кол-ва тепла.
К. используют для интенсификации
разл. процессов (напр., при выплавке стали). Жидкий К. служит окислителем ракетного
топлива, его применяют при изготовлении взрывчатых веществ. Озон ядовит, способен
сильно раздражать глаза и дыхат. пути. Находит применение искусств. 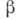 --радиоактивный
нуклид 19O (
--радиоактивный
нуклид 19O (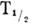 =27
с).
=27
с).

С. С. Бердоносов
|
|