4.7. Азот
Азот располагается в таблице Менделеева под седьмым номером; его атомная масса равна 14,0067. Он представляет собой бесцветный газ и входит основной составляющей частью (78 процентов) в атмосферу Земли; обнаружен он также в газовых туманностях Вселенной и в солнечной атмосфере; есть он на Уране, Нептуне и на других планетах.
В природных условиях азот представлен в молекулярном виде; его молекула состоит из двух атомов; она — очень прочная и распадается лишь при нагреве выше 3000 градусов Цельсия. Азот сжижается при температуре ниже минус 196 градусов, а затвердевает ниже минус 210 градусов. В твердом состоянии он образует кубические и гексагональные модификации.
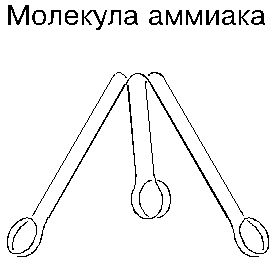
Азот химически малоактивен: в нормальных условиях он взаимодействует лишь с литием, образуя кристаллы. В то же время известны самые различные соединения азота. С водородом он образует аммиак, молекула которого состоит из одного атома азота и трех атомов водорода. Аммиак — тоже газ и тоже бесцветный; он сжижается при температуре ниже минус 34 градусов, а затвердевает ниже минус 78 градусов; получают его синтезом из простых веществ при температуре 400 … 500 градусов, под давлением 5 … 1000 атмосфер и в присутствии катализатора (обычно железа). Аммиак выделяется также при коксовании каменного угля. Современная химия представляет молекулу аммиака в виде трехгранной пирамиды с атомами в ее вершинах; атомы водорода в ней разнесены под углом 107 градусов.
Известны еще несколько соединений азота с водородом, и наиболее распространенное из них — гидразин (или диамид) — бесцветная жидкость, затвердевающая при температуре ниже двух градусов и закипающая при 113,5 градусах Цельсия. Молекула гидразина содержит два атома азота и четыре атома водорода. Гидразин менее устойчив, чем аммиак, и на воздухе горит с большим выделением тепла.
Из других соединений азота упомянем азотную кислоту, молекула которой состоит из одного атома азота, одного атома водорода и трех атомов кислорода; это — бесцветная жидкость, кипящая при 84,1 градусе, а при минус 41,6 градуса затвердевающая в прозрачную кристаллическую массу. Водный раствор азотной кислоты разрушает животные и растительные ткани, соединяется почти со всеми металлами и неметаллами.
Отметим еще так называемые нитриды — соединения азота с металлами и неметаллами. Одно такое соединение с литием мы уже упоминали: оно легко образуется, но также легко распадается при температуре выше 300 градусов. Другие нитриды металлов возникают труднее, но и отличаются высокой температурой плавления, что говорит о их термической и химической стойкости. Они характеризуются металлическим блеском, электронной проводимостью, а также высокой твердостью. Нитриды могут включать не один металл, а сплавы. Атомарные соотношения нитридов могут быть некратными, то есть на один атом металла может приходиться менее одного атома азота. Нитриды неметаллов — соединения с бором, с алюминием, с кремнием — известны как твердые полимерные вещества с температурой плавления выше 2000 градусов; они являются либо диэлектриков, либо полупроводниками.
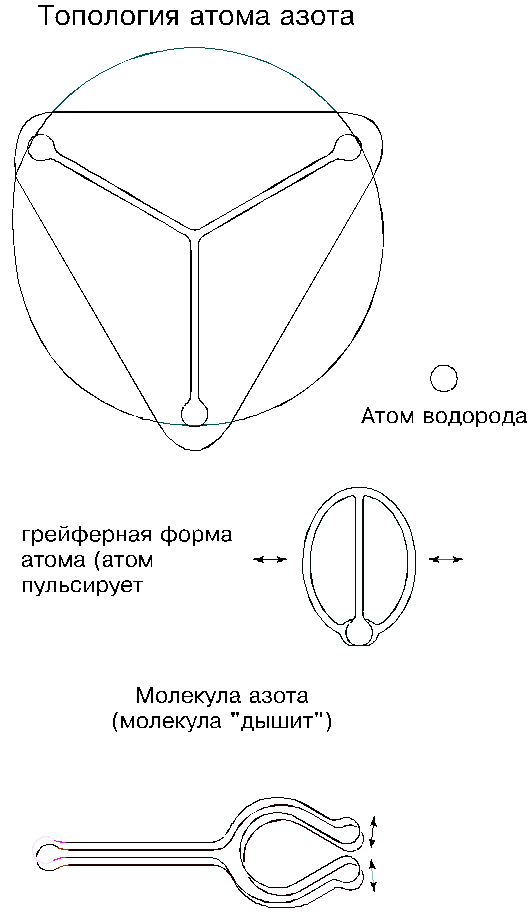
Топология атома азота — оригинальная; об этом говорит его петлевая валентность: он присоединяет к себе нечетное количество атомов водорода, а именно три. Номинальная длина шнура исходного тора атома составляет 25 700 эфирных шариков; это относительно длинный шнур, и поэтому деформация тора идет не по пути складывания его вдвое, а —втрое: сначала окружность тора прогибается с трех сторон, затем образовавшиеся три выступа вытягиваются в лучи (лепестки), и на их концах возникают петли; так формируется трехлепестковый атом азота. Если проследить за топологией одиночного атома дальше, то можно отметить, что лепестки изогнутся в одну сторону и сойдутся вместе, уткнувшись вершинами петель друг в друга; атом приобретет грейферную форму.

Но скорее всего, до этой грейферной формы дело не дойдет: трехлепестковые атомы при случайных столкновениях будут образовывать двухатомные молекулы. В молекуле азота три петли одного атома прилипают к таким же трем петлям другого; слипаются также их лучи, так как они представляют собой желоба. Оценивая силу сцепления атомов в молекуле азота, можно сказать, что она очень большая; и для того, чтобы разорвать молекулу, нужно приложить огромное усилие.
Молекула могла бы быть вообще нерасторжимой, если бы не два обстоятельства. Первое: размеры атомов в молекуле — не одинаковые, и поэтому их взаимное прилегание — далеко не идеальное; если и встречаются идеальные пары, то они — большая редкость, и у них судьба — жить на пару почти вечно. Второе: спаренные лепестки молекулы испытывают взаимное влечение, и два из них попытаются максимально сблизиться между собой, но им будет противостоять упругость шнуров; борьба этих сил породит неустойчивость в виде порхания спаренных лепестков; колебания отдельных лепестков определяются их индивидуальными характеристиками, и поэтому лепестки в паре будут колебаться невпопад — это еще больше ослабит молекулу.
Порхания спаренных лепестков порождают вокруг молекулы стоячее тепловое поле, и это поле делает молекулу пушистой. Колеблются не только сблизившиеся лепестки, но и оставшийся одиночный, хотя в меньшей степени; и он будет дополнительно раскачивать тепловое поле. Отсюда, азот
— газ.Петлевые соединения атомов азота с атомами других химических элементов хорошо иллюстрируются на примере аммиака: атомы водорода прилипают в нем к присасывающим сторонам петель атома азота, “грейфер” при этом распускается и приобретает вид трехгранной пирамиды, а точнее сказать — три лепестка молекулы с прилипшими на концах водородными колечками расходятся так, что образуют между собой углы порядка 100 градусов. Говорить о том, что эти углы равны точно ста семи градусам, было бы не совсем правильно: учитывая то, что отогнутые лепестки молекулы аммиака не могут в нормальных условиях не колебаться, углы эти имеют переменные значения. Указанные колебания, очевидно, усиливают тепловое поле молекулы, создаваемое в основном атомами водорода; поэтому аммиак — тоже газ. Подчеркнем, что во всех петлевых соединениях азот всегда трехвалентен.
Соединения с помощью желобов атомы азота могут образовывать со всеми металлами и теми неметаллами, которые имеют свои открытые присасывающие желоба. Особняком в этом ряду стоит нитрид лития, который не требует для своего образования специальных условий. Атомы лития легко проникают внутрь “грейфера” атома азота и прилипают там своими желобами и желобами лепестков азота, у которых присасывающие стороны обращены вовнутрь; при этом лепестки расходятся, давая возможность атомам лития слипнуться между собой в центре. Длины лепестка хватает почти на весь присасывающий контур атома лития. В раскрытом виде три присасывающих желоба атома азота могут присоединить к себе атомы других элементов в разном количественном и дробном соотношении. В этом случае азот выступает в роли клея наподобие углерода и способствует упрочнению материалов: склеенные азотом металлы повышают свою твердость и тугоплавкость, сохраняя свои металлические свойства.
Бесцветность азота объясняется опять же тем, что лепестки его атомов колеблются на частотах, не регистрируемых рецепторами человеческого глаза.
Топология атома азота позволяет объяснить такую особенность азотных соединений, что в результате их переподсоединений может выделяться огромное количество тепла, а иногда такой процесс идет со взрывом. Молекулы с участием азота могут представлять собой либо пространственные конструкции, либо сугубо плоские; пространственные, да еще возбужденные молекулы вместе со своими тепловыми полями занимают очень большой объем, а плоские, наоборот, сравнительно малый. Поэтому, если молекуле представится возможность преобразоваться из пространственной в плоскую, то она сделает это с большим желанием: ее потенциальная энергия в этом случае перейдет в кинетическую; выделившееся тепло побудит соседние молекулы сделать то же самое; те, в свою очередь, подтолкнут другие молекулы, и процесс примет цепной характер в виде взрыва.
|
|