"Спору нет, идея ваша - сумасшедшая. А вот достаточно ли она сумасшедшая, чтобы быть правильной?"
Нильс Бор (наверное, о себе)

 |
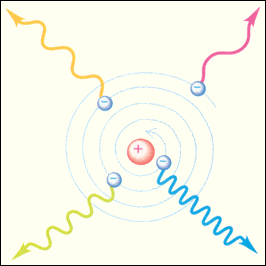
| Рисунок 1. Неустойчивость модели атома Резерфорда |
Планетарная модель атома, предложенная Резерфордом, – это попытка применения представлений о планетарном движении космических тел к явлениям атомных масштабов. Эта попытка оказалась несостоятельной. Модель Резерфорда не могла объяснить устойчивость атома. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн (рис. 1).
Следующий шаг в развитии представлений об устройстве атома сделал в 1913 году датский физик еврейского происхождения Нильс Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты (недоказуемые утверждения, принимаемые на веру), которым должна удовлетворять новая теория о строении атомов. Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En.
В стационарных состояниях атом не излучает. Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (рис. 2). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En < 0. При En ≥ 0 электрон удаляется от ядра (ионизация). Величина |E1| называется энергией ионизации. Состояние с энергией E1 называется основным состоянием атома.
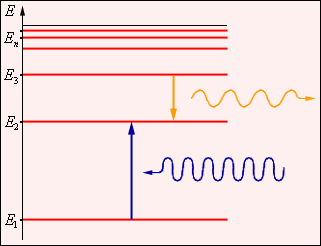 |
| Рисунок 2. Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов. |
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
|
где h – постоянная Планка. Отсюда можно выразить частоту излучения:
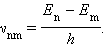 |
Второй постулат Бора также противоречит электродинамике Максвелла, так как частота излучения определяется только изменением энергии атома и никак не зависит от характера движения электрона. Модель Бора не смогла уйти от недостатков планетаной модели атома Резерфорда. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра, впав при этом в логическкий нонсенс: "электрон движется и не движется в одно и то же время". Дополнение ядерной модели атома Резерфорда идеей о квантовании электронных орбит не решило проблемы объяснения отсутствия излучения при движении электронов по орбитам. Скорости перемещения электронов с орбиты на орбиту оказываются мгновенными, то есть сверхсветовыми, а это означает следующее:
Поэтому теорию Бора иногда называют полуклассической ("полуумной"?), а ее последователей "копенгагенской школой". В ней, как мы видим множество логических неувязок, нонсенсов, достаточных для того, чтобы отнести ее к "клинической физике".

|
|