Dipl.-Ing. Johann Kern, Stuttgart
Es wird das neue Atommodell, daß in [1] nur schematisch dargestellt ist, weiter entwickelt. Es wird gezeigt, daß wenn Elementarteilchen nicht in Form von Kügelchen, sondern in Form von Ringen dargestellt werden, kann man viele, darunter auch bis jetzt praktisch nicht erklärbare, chemische Eigenschaften der Atome und Moleküle folgerichtig modellieren. Die Begriffe der chemischen Valenz oder Passivität werden anschaulich und physikalisch klar definiert.
Einführung.
Überlegungen, die Dmitrij Mendelejew (1834-1907) bei der Vorstellung seiner Periodensystem der chemischen Elemente angeführt hat, würde man heute wahrscheinlich als spekulative bezeichnen. Der eigentliche Wert der Periode (Anzahl der Elemente in einer Periode) ist bis jetzt eindeutig nicht festgelegt. Die Verletzung der festgelegten Anzahl der Elementen in einer Periode fängt schon in erster Periode an: sie enthält nur 2 Elemente. Für die Wissenschaftler, die meinen, dass die Periode je 8 Elementen enthalten soll, sind die zweite und dritte Periode vollzählig, für die anderen gähnt auch in der 2. und 3. Periode immer noch ein gewaltiges Loch. Und das ist noch weit nicht alles, was man bemängeln könnte. Man muß schon sehr nachlässig sein, um das System als Periodensystem zu bezeichnen. Und doch ist es weltweit anerkannt und nützlich.
Auch die Gleichungen von Maxwell (1831-1879) sind auf sehr ungewöhnliche Weise entstanden, heutzutage hätte er sehr große Schwierigkeiten gehabt sie in einer wissenschaftlichen Zeitschrift zu veröffentlichen. Man will seine Nachweismethode bis heute nicht anerkennen, seine Überlegungen bezeichnet man bis heute als nicht nachgewiesene: „Maxwells Vermutungen, die er 1864 nur spekulativ äußern konnte, zählen heute zum Bestand gesicherter physikalischer Erkenntnisse“ [2]. Nicht alle waren so penibel. „Die Eleganz von Maxwells Gleichungen begeisterte Ludwig Boltzmann(1844-1906) zu dem Ausruf: „War es ein Gott, der diese Zeichen schrieb...?““ [3]. Allerdings sagte er dies schon nach dem, als Heinrich Hertz (1857-1894) seine Versuche durchgeführt hat. Auch Maxwells Gleichungen sind jetzt weltweit anerkannt, aber vielleicht nur dank H. Hertz, der in der Arbeit von Maxwell (22 Jahren nach der Veröffentlichung!) die Möglichkeit der Fernübertragung der elektromagnetischen Energie entdeckt hat.
Auch Überlegungen Kopernikus (1473-1543), die nachweisen sollten, dass die Sonne das Zentrum des Universums ist, würde man heute nicht anders, als spekulativ bezeichnen: Seine Berechnungen lieferten sehr ungenaue Ergebnisse in Vergleich mit Berechnungen nach dem damals anerkanntem heliozentrischem System. Um die Richtigkeit seines Systems ganz streng zu beweisen, waren noch mehr als hundert Jahren und die Ergebnisse von Kepler (1571-1630) und Newton (1643-1727) notwendig.
Hier weiter werden spekulative Überlegungen angeführt, die die Welt der Atome und Moleküle sehr anschaulich und viel verständlicher machen können. Strenger Nachweis dieser Überlegungen würde eine Arbeit von vielen Monaten wenn nicht von vielen Jahren eines beträchtlichen Forscherteams verlangen.
1. Ein anschaulich passives He-Atommodell
Die in [1] gemachte Annahme, daß die Anziehungskraft zwischen Atomkern und Elektron bei immer kleiner werdendem Abstand zwischen ihnen in eine Abstoßungskraft übergeht, erlaubte einige physikalische Eigenschaften glaubhafter darzustellen. In diesem Beitrag wird versucht das in [1] dargestellte Atommodell weiter zu entwickeln und damit den chemischen Eigenschaften anzupassen.
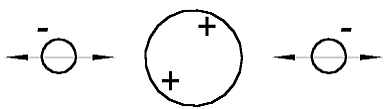
Nach der Annahme in [1] muß das He-Atom (Heliumatommodell), so aussehen, wie es in der Abb. 1.1 gezeigt ist. Es besteht aus einem positiv geladenen Atomkern (große Kugel) und zwei negativ geladenen Elektronen (kleine Kügelchen). Rein schematisch ist das Atomkern als ein größeres Kügelchen gezeigt, als die Elektronen, weil es viel (in etwa 7000 mal) schwerer ist. Die beidseitige Pfeile sollen zeigen, daß das Elektron um sein Gleichgewichtspunkt schwingen kann.

Abb. 1.1. Das Helium-Atommodell entsprechend dem Beitrag [1]
Man weis, daß das Helium-Atom keine chemische Verbindungen eingeht. Man kann sich aber nach dem Modell in der Abb. 1.1 vorstellen, daß eins der Elektronen des He-Atoms von dem Atomkern des anderen He-Atoms angezogen wird und auf diese Weise eine (chemische) Bindung entsteht (Abb. 1.2).
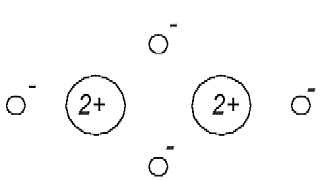
Abb. 1.2. Das Helium-Atommodell, daß dem Beitrag [1] entspricht, ist nicht chemisch passiv
Solches ist aber nicht bekannt. Darum muß man vermuten, daß das He-Atom, damit es keine Bindungen eingehen kann, anders aussehen muß. Sicher, man könnte etwas ähnliches sagen, wie es in der Quantenphysik gesagt wird, daß “die Elektronen-Schale des He-Atoms mit zwei Elektronen schon voll ist” und darum Helium keine Bindungen eingehen kann. Solche (Zauber-)Sprüche möchte man aber meiden. Das passive chemische Verhalten muß aus dem He-Atommodell selbst folgen, aus seiner Beschaffenheit, nicht aber aus einem Spruch. Dies kann man erreichen, wenn man annimmt, daß Elektronen und Atomkerne keine Pünktchen (Kügelchen), sondern Ringe (Toruse) darstellen. (Ein Torus hat einen kleinen und einen großen Radius. Weiter wird der Kürze halber der große Radius nur als Radius genannt. Wenn es um den kleinen Radius geht, wird das Wort Dicke verwendet, unter der der kleine Durchmesser des Torus gemeint wird). Wenn der Elektronring und der Atomkernring des Heliums ungefähr den gleichen Radius haben, dann wird das He-Atom ungefähr so aussehen, wie in der Abb. 1.3 gezeigt ist.
Die zwei Elektronringe befinden sich von beiden Seiten des Atomkernrings in einem gewissen Abstand von ihm. (Elementarteilchen stellen viele
Forscher als (Wirbel)Ringe vor, als Beispiel kann man das Buch von K. Meyl [4] erwähnen.) Die zwei dünne Ringe sollen Elektronen, der dicke Ring den He-Atomkern darstellen. (Die Zeichnung hat keinen naturgetreuen Maßstab. Die große Durchmesser der Ringe müssen im Vergleich mit dem Abstand zwischen ihnen viel größer sein.) Die Ringe befinden sich in Gleichgewichtslage. Bei größerem Abstand von dem Atomkernring werden sie angezogen, bei kleinerem - abgestoßen.
Jeder kann sich überzeugen, daß das He- Atommodell nach der Abb. 1.3 mit
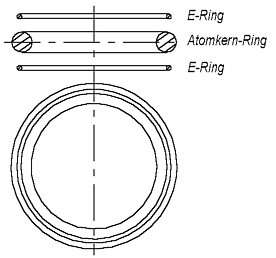
Abb. 1.3. Das Helium-Atommodell
beschriebenen Eigenschaften weitgehend chemisch passiv sein muß. Das bedeutet - es kann sich einem anderen Atom oder Molekül nicht anschließen. Wenn man versuchen wird zwei He-Atome nach der Abb. 1.4. in Kontakt zu bringen, kann man sehen, daß die
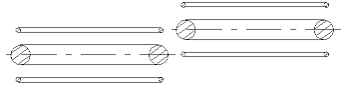
Abb. 1.4. Die mögliche Verbindung zwischen zwei Helium-Atommodellen ist sehr schwach. Sie befindet sich kraftmäßig weit unter der Kraft einer chemischen Verbindung. Aber sie ist ausreichend stark, um bei sehr niedriger Temperatur aus den Helium-Atomen eine Flüssigkeit zu bilden.
Anziehungskraft eines Elektrons zu seinem eigenen Atomkernring in jeder Lage unvergleichlich größer sein wird, als zum Atomkernring eines benachbarten Atoms. Eine ausreichend starke Bindung zwischen zwei He-Atomen, die man als chemische Bindung bezeichnen könnte, kann es nicht geben. Das He-Atommodell, wie man weiter aus den anschaulichen Darstellungen der Atommodelle sehen kann, ist das passivste unter allen Atomen. Daß man aus den früheren Darstellungen der Atome die Passivität des Heliums sehen kann, kann keiner behaupten. Dort mußte man einfach glauben, daß die zwei Elektronen des Helium-Atoms “eine volle Schale” bilden und daß dies die chemische Passivität bedeutet.
Anmerkung über die Übereinstimmung des Ringen-Modells mit bekannten experimentellen Daten
In [1] wurde schon angedeutet, daß Rutherford nicht alle Möglichkeiten berücksichtigt hat, als er behauptete (im Widerspruch mit Experimenten von Hertz und den Gleichungen von Maxwell), daß man zwingend annehmen muß, daß das Elektron um das Atomkern kreist und dabei keine Energie ausstrahlt. Als er feststellte, daß das Atomkern und das Elektron einen sehr kleinen Volumen des Atomvolumen einnehmen, nahm er ohne jede Diskussion an, daß sie beide die Form eines Kügelchen haben. Sicher, er folgte dabei einer sehr langen Tradition: Wenn man nicht weis, wie etwas kleines aussieht, vermutet man, daß es die Form eines Kügelchen hat. In seiner Situation hätte wahrscheinlich jeder das gleiche gemacht. Man muß hier nur bemerken, daß diese Form kein zwingendes Ergebnis seiner Experimente war.
Der Einfangsquerschnitt der Elektronen ändert sich in der Luft von 3.10-20 m² bis 3.10-26 m² bei Änderung des elektrischen Potentials von 300 V bis 660 kV [5]. Das bedeutet, daß bei chemischen Reaktionen, die im Bereich von nur paar eV liegen, das Betrachten der Elektronen als Kügelchen mit einem Radius von r = 1,41.10-15 m (also Querschnitt in etwa 6.10-30 m²) total falsch sein kann. Die Darstellung der Elektronen als Ringe widerspricht aus dieser Sicht der Realität nicht, sondern kommt ihr näher.
Langsame Neutronen haben einen Einfangsquerschnitt, der 105 größer ist, als der angenommene geometrische Querschnitt [6]. Also auch hier haben langsame Elementarteilchen (Neutronen) einen größeren (Einfangs-)Querschnitt, als die schnelleren. Wenn man die Elementarteilchen als Kügelchen darstellt, sind dieseTatsachen nur schwer erklärbar.
Wenn man sie aber als Ringe darstellt, kann man dieses Ergebnis leichter begreifen. Nach unserem Modell müssen Alfa-Teilchen auch Ringe darstellen. Stellen wir uns vor, daß Alfa-Teilchen mit ihrer Ringebene aus einem Alfa-Strahler nur parallel der Geschwindigkeitsrichtung rausfliegen. Man kann sich noch vorstellen, daß dieser Ring um seine Rotationssymmetrieachse sehr schnell rotiert. Wir wissen, daß so ein Ring die Richtung seiner Drehbewegung sehr gut beibehalten kann. Die Atomkernringe der Goldfolie, weil sie vom Ring des Alfa-Teilchen abgestoßen werden, können am besten dem Zusammenstoß „ausweichen“, indem sie eine Position parallel dem Ring des anfliegendem Alfa-Teilchen einnehmen. Sie lassen also daß Alfa-Teilchen „passieren“. Außerdem, kann man sich vorstellen, daß einer der Ringe durch den anderen durchfliegen kann, indem sich einer wegen der entstehenden Abstoßungskräfte ein bischen dehnt und der andere sich entsprechend ein bischen zusammenzieht. Ein unausweichlicher Zusammenstoß passiert nur dann, wenn der Atomkernring der Zielfolie (Targetfolie) genau parallel dem Ring des Alfa-Teilchens ist und genau im Wege steht. Wenn man dies alles berücksichtigt, kann man verstehen, daß ein Zusammenstoß in unserem Fall genau so selten sein kann, wie in dem Fall, wenn beide Teilchen kleine Kügelchen darstellen: der Querschnitt des Teilchens wird uns sehr klein zu sein scheinen. Andererseits, bei kleiner Geschwindigkeit wird die Energie des Teilchens schnell verbraucht und sein „Querschnitt“ wird plötzlich unvergleichlich groß erscheinen.
2. Das Modell des Wasserstoffatoms.
Wenn man jetzt auf ähnliche Weise das H-Atommodell in Form von zwei Ringen mit gleichen Durchmessern, einem dünnen Elektronring und einem dickeren Atomkernring (Abb. 2.1) darzustellen versucht, dann wird man damit keinen Erfolg haben.
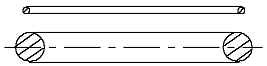
Abb. 2.1. Entsprechend der Abb. 1.3 könnte das H-Atommodell so aussehen.
Ein H-Atom nach der Abb. 2.1 kann eine unendliche Reihe mit anderen solchen H-Atommodellen bilden (Abb. 2.2), weil ein dünner Ring (ein negativ geladenes Elektron)
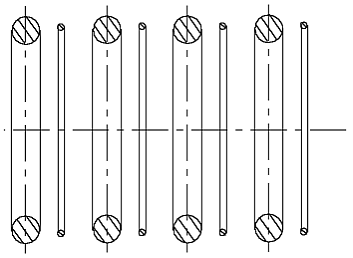
Abb. 2.2. Ein solches Wasserstoffatommodell könnte eine unendliche Kette aus Atomen bilden. Das Atommodell ist falsch.
immer von einem dicken Ring (einem positiv geladenem Atomkern) angezogen wird. Eine unendliche Kette aus Wasserstoffatomen ist keinem bekannt, sie entspricht der Wirklichkeit nicht. Also ist dieses Modell falsch. Man möchte sich aber so leicht von einer so schöner Idee, die uns die greifbare Passivität des He-Atommodells gegeben hat, nicht absagen. Man kann feststellen, daß um ein natürlicheres H-Atommodell aufzubauen zu können, muß der Radius des Proton-Rings (ungefähr) zwei mal kleiner, als der Radius des Elektron-Rings sein.
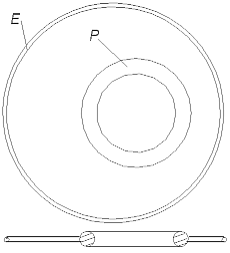
Abb. 2.3. H-Atommodell
In diesem Fall wird ein H-Atommodell wie in der Abb. 2.3 aussehen. Der dicke kleine Ring - das Proton - befindet sich innerhalb des dünnen großen Ringes - dem Elektron, aber nicht ganz im Zentrum, sondern mehr an der Peripherie. Nur in diesem Fall wird das Modell des H2-Moleküls energetisch gesehen glaubhaft, weil auch in ihm nur ein Teil des Protonrings mit einem Teil des Elektronrings sich binden muß. Das H2-Molekül besteht aus zwei dünnen Ringen (zwei Elektronen), und zwei kleineren dicken Ringen (zwei Protonen). Es kann so aussehen, wie in der Abb. 2.4 gezeigt ist. Das Modell ist symmetrisch, alle Ringe sind im stabilen Gleichgewicht. Wie jede stabile Molekül-Konstruktion ist sie ausreichend chemisch passiv, wie es einem Molekül auch gehört, aber weniger passiv, als das He-Atom.
Abb. 2.4. Das Modell des H2-Moleküls 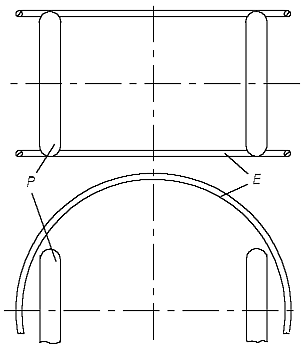
Gerade die ausreichende chemische Passivität des H2-Moleküls stellt einige Bedingungen zur Größe des Radius des Protons. Damit das H-Atommodell keinen H-Polymer (Abb. 2.2) bilden kann, wäre schon ausreichend, wenn der Radius des Protonrings nur ein bißchen kleiner wäre, als der Radius des Elektronrings. Damit aber auch das H2-Molekül ausreichend passiv sein wird, muß der Radius des Protonrings noch kleiner werden.
Man muß gar nicht anstreben, daß zwischen H2-Molekülen in jeder Lage es nur Abstoßungskräfte gibt. Bei ausreichend niedrigen Temperaturen wird Wasserstoff sich verflüssigen, und bei noch niedrigeren Temperaturen gefriert er. Das bedeutet, daß es Lagen geben muß, in welchen H2-Moleküle sich miteinander mit kleiner Kraft, aber immerhin verbinden. Und alle diese Kräfte und Zustände müssen bei der Berechnung des Protonringradius berücksichtigt werden. Dies aber ist nicht das Ziel dieser Arbeit, darum wird weiter angenommen, daß der Protonringradius ungefähr der Hälfte des Elektronringradius entspricht, ohne zu versuchen ihn genauer zu bestimmen.
3. Modelle des Kohlenstoffs und des Methans
Das sechste Atom - der Kohlenstoff - hat sechs Elektronen, von ihnen vier Valenzelektronen. Man kann davon ausgehen, daß die erste zwei Elektronen die gleiche Lage haben, wie bei Helium. Auch den Durchmesser des Atomkernrings kann man wie bei Helium annehmen. Die Lage der Valenzelektronen ist davon abhängig, wie weit die zwei erste Elektronen sich vom Atomkernring befinden. Wenn sie sehr nah zum Atomkernring sind, dann werden die anderen Elektronringe seitlich zum Atomkernring angezogen. Wenn sie aber ziemlich weit vom Atomkernring sind, dann kann das Kohlenstoffatom (C-Atom) so aussehen, wie in der Abb. 3. 1 gezeigt ist. Die zwei erste Elektronenringe sind symmetrisch und parallel zum Atomkernring plaziert, die anderen vier sind senkrecht zu ihm. Diese Lage der Valenzelektronenringe ist viel bequemer für die Darstellung der chemischen Eigenschaften
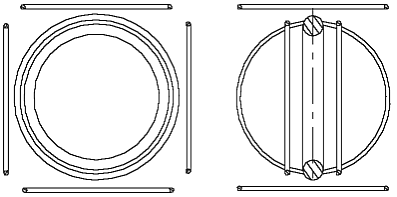
Abb. 3.1. Modell des Kohlenstoffatoms
des C-Atoms (Es ist gemeint, daß man sich auch andere logische Lagen der Elektronen vorstellen kann). Das dargestellte Modell des C-Atoms ist ziemlich kompliziert. Um die weitere Darstellung einfacher zu machen, hat es einen Sinn die Zeichnungen zu vereinfachen, sie mehr symbolisch darzustellen. Um das zu schaffen, zertrennen wir gedanklich den Atomkernring und entfalten ihn in einen Stab. Die Dicke des Stabs symbolisiert den kleinen Durchmesser des Atomkernrings.
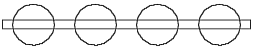
Abb. 3.2. Vereinfachte (schematische) Darstellung des Kohlenstoffmodells
Die zwei Elektronen, die parallel dem Atomkernring sind und keine Rolle bei den chemischen Reaktionen spielen, werden weiter überhaupt nicht gezeigt. Die verbliebenen Valenzelektronenringe werden nicht als Ringe, sondern als einfache Kreise dargestellt. Auf diese Weise kann man aus der Abb. 3.1 die viel einfachere Abb. 3.2 bekommen.
Wegen seinem kleineren Atomkernring (Proton) muß sich das Wasserstoffatommodell (Abb. 2.3) leicht mit einem zweiten Elektronring verbinden. Diese Verbindung ist in der Abb. 3.3 (a und b) gezeigt. Sie besteht aus einem Proton und zwei Elektronen. Man kann diese

Abb. 3.3a. Negativer Wasserstoff-Ion H-
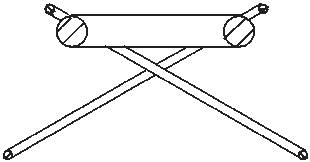
Abb. 3.3b. Negativer Wasserstoff-Ion H- in der Nähe des Atomkern (nicht gezeigt) eines anderen Atoms Verbindung als H- bezeichnen.
Das ist ein negativer Wasserstoff-Ion. Er kann ziemlich flach dargestellt werden (Abb. 3.3a), obwohl in einer Bindung mit anderen Atomkernen er sich in ein räumliches Gebilde verwandelt (Abb. 3.3b). Die flache Variante ist bequem bei vereinfachten Darstellungen der Moleküle (z.B. weiter in der Abb. 3.4), die räumliche wird verwendet bei Darstellung des gemeinten wirklichen Bildes des Moleküls. Diese Verbindung wird weiter mehrmals benutzt. Wenn sie in der Chemie vielleicht nicht sehr bekannt ist, dann nur aus dem Grunde, weil sie fast immer ein Bestandteil der uns bekannten Verbindungen, die mindestens zwei Atomkernringen enthalten, ist.
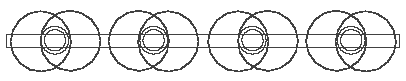
Abb. 3.4. Methan CH4, schematische Darstellung
Vier Wasserstoffatome bilden mit den vier Valenzelektronen des C-Atoms (Abb. 3.1 oder 3.2) vier H--Verbindungen, die, weil sie elektrisch negativ sind, sich an das elektrisch positive C-Atomkern klammern und damit den Methan CH4 bilden. In der schematischer “flacher” Darstellung (Abb. 3.4) sieht Methan sehr einfach, das räumliche dreidimensionale Modell (Abb. 3.5) aber viel komplizierter aus. Die dünne Ringe in der Abb. 3.5 sind
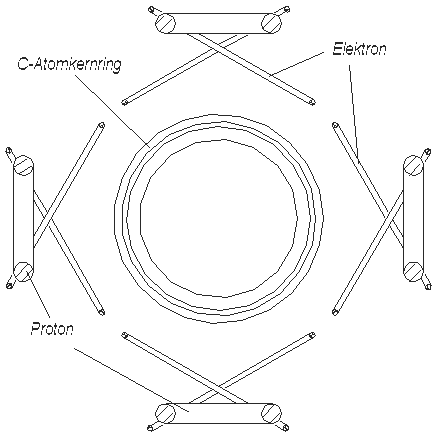
Abb. 3.5. Methan CH4, räumliche Darstellung
Elektronen, die kleinen dicke - die Wasserstoffatomkerne (Protonen), der große dicke Ring - der Kohlenstoffatomkern. In der räumlichen Darstellung sind die 4 H--Elemente (Abb. 3.5 und 3.3b) auch nicht flach, sie sind gewinkelt, und darum auch dreidimensional.
Man kann sich vorstellen, daß das Wasserstoffatom mit anderen Atomen (fast) immer unter Bedingung des Bilden des Elements H- (Abb. 3.3) sich verbindet. In diesem Falle können sich ausreichend passive Moleküle der Wasserstoffverbindungen bilden.
4. Physikalische Definition der Valenz
Nach dem Aufbau des Modells des Methanmoleküls CH4 kann man schon vermuten, was in den neuen Atommodellen eigentlich Valenz ist. Das Wort Valenz wird übersetzt aus dem Lateinischen als Möglichkeit und bedeutet, z.B. die Möglichkeit mit einem anderen Atom eine Verbindung zu bilden. In unserem Fall ist Valenz die Möglichkeit für einen Elektron des Atoms 1 einen „Anlegeplatz“ am Atomkern des Atoms 2 zu finden. Aber nicht für den ganzen Elektron, sondern nur für einen Teil seines Ringes. Andererseits, muß gleichzeitig ein Elektron (ein Teil seines Ringes) des Atoms 2 einen entsprechenden „Anlegeplatz“ am Atomkern des Atoms 1 finden. (Es ist also eine gewisse Analogie mit der anerkannten Bindung mit Hilfe von Elektronenpaaren da.)
Die Valenz ist einerseits die Möglichkeit eines Teils eines Elektronrings eines Atoms sich in der Nähe eines Atomkernrings eines anderen Atoms aus rein elektrostatischen Gründen einen “Anlegeplatz” zu finden, das heißt, einen Platz, wo der Teil des Elektronrings angezogen werden kann. Und umgekehrt, der Atomkernring muß sich teilweise mit einem Teil eines Elektronrings des anderen Atoms verbinden. Es müssen an der chemischen Bindung immer mindestens zwei Atomkernringe und zwei Elektronringe beteiligt sein.
Weil bei der Annäherung die Anziehungskraft immer in Abstoßungskraft übergeht, kann man auch immer sagen, daß die chemische Bindung eine ausreichend starke Wechselwirkung der elektrischen Felder der Teile der Atomkern- und der Elektronringe bedeutet. Der Grund der Bindung ist immer die elektrostatische Anziehungskraft und die Gewinnung der Energie bei diesem Akt.
Nach der oben dargestellten Definition der Valenz könnte man leicht auch eine Verbindung von zwei He-Atome zeigen. Aber wenn wir He-Atommodelle entsprechend der Abb. 1.3 benutzen würden, könnten wir eine Energiegewinnende Darstellung einer solcher Verbindung nicht erreichen. Ein Elektronring des He-Atoms (Abb. 1.3) kann so gut wie nie (nur bei sehr niedrigen Temperaturen) an einem anderen Atomkernring einen gewinnbringenden “Anlegeplatz” finden, weil er zu stark mit dem eigenen He-Atomkernring verbunden ist. Darum hat das He-Atom keine Möglichkeit (keine Valenz) sich mit anderen Atomen zu binden. Anders gesagt, das He-Atom hat die Valenz Null. Umgekehrt, der Elektronring des H-Atoms (Abb. 2.3) ist mehr als zur Hälfte so gut wie nackt, er kann von jedem nicht gut genug von eigenen Elektronenringen abgeschirmtem Atomkernring angezogen werden. Nicht aber von dem Atomkernring des Heliums. Der ist sehr gut abgeschirmt von seinen zwei eigenen Elektronringen. Gleichzeitig auch ein Teil des H-Atomkernrings (die von eigenem Elektron abgewandte Seite) kann leicht mit einem Teil des Elektronrings eines anderen Atom sich binden. Also für die Verwirklichung der Valenz muß es nicht Elektronen-Paare geben, wie es behauptet wird, um die symbolische “Elektronen-Schale” “voll” zu machen, sondern einen ausreichend “nackten” Elektronring und ein Platz für ihn in der Nähe eines Atomkernringes, und umgekehrt. Zwischen Teilen der geladenen Ringen der Elementarteilchen wirken ganz normale elektrostatische Anziehungs- und Abstoßungskräfte.
Die Anzahl der Valenzelektronen war ein scheinbar materialistischer Grund der Valenz, in Wirklichkeit ist es ein rein mystischer Grund. Das können wir unter anderem aus folgendem sehen. Uns ist bekannt, daß das H-Atom einen einzigen Elektron hat, darum kann es “Elektronenpaare” nur mit einem anderen Atom bilden. Es gibt aber Fälle (z.B. in Borhydriden), daß man gezwungen wird zu sagen, daß das einzige Elektron des H-Atoms zwei andere Atome verbindet. Die Erklärung ist dann natürlicherweise sehr künstlich und nicht glaubhaft. Genauso klappt es nicht mit den “vollen Schalen”. Die Edelelemente dürften (wegen der vollen Schale) auf keinen Fall Bindungen mit irgend einem Atom bilden. Tun sie aber. Nach der im Abschnitt 1 dargestellter Vorstellung können Modelle aufgebaut werden, in welchen die Valenz einen anderen, nicht abstrakten Sinn hat. Ob ein Atom sich mit einem anderen verbinden kann oder nicht, kann man sofort nicht nur sehen, sondern auch abtasten, fühlen. Man bekommt die Möglichkeit sich mehrmals anschaulich zu überzeugen, daß das H-Atom nicht nur wirklich 2 andere Atome binden kann, sondern daß es aus der Sicht der oben gegebenen Definition der Valenz ein ganz normaler Fall ist, der überhaupt keine besondere Erklärung braucht.
Eine Bedingung muß aber immer erfüllt sein: das Bild der Atomen, die sich verbinden, muß richtig sein. Wenn etwas falsch funktioniert, können wir überzeugt sein: das Bild des Atoms oder des Moleküls ist nicht ganz richtig dargestellt. Und damit bekommt man die Möglichkeit die entsprechende Vorstellung über das Aussehen eines Atoms oder eines Moleküls zu verbessern. Mit dem neuen Atommodell kann man sich langsam zur richtigen Darstellung vortasten.
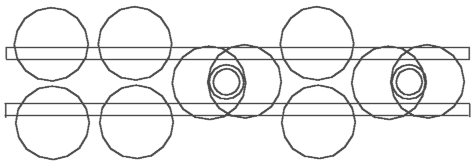
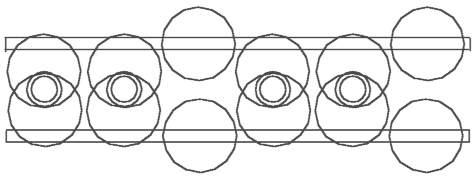
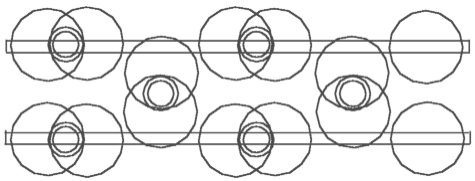
Abb. 4.1. Acetylen - C2H2 Abb. 4.2. Äthylen - C2H4 Abb. 4.3. Äthan - C2H6
Aufgrund der oben schon dargestellten Modelle kann man jetzt sehr leicht das schematische Modell von Acetylen - C2H2 (Abb. 4.1), Äthylen - C2H4 (Abb.4.2) und Äthan - C2H6 (Abb. 4.3) feststellen. Schauen wir uns das Modell von Acetylen - C2H2 genauer an. Man kann behaupten, daß die H-Atome die zwei C-Atomkernringe verbinden. Wir haben hier eine ganz andere Funktion der H-Atome. In der anerkannten schematischer Darstellung der Strukturformel von C2H2 verbinden sich H-Atome mit C-Atomen. Hier aber verbinden H-Atome die C-Atome. Und umgekehrt - die C-Atome spielen in diesen Verbindungen eine ziemlich passive Rolle: sie verbinden nichts, sie lassen die Verbindung zu.
5. Warum gibt es kein Boran?
(Noch eine Definition der Valenz. Warum haben einige Elemente mehr als eine Valenz?)
Nach den dargestellten Modellen der Atome und Moleküle wird klar, daß anstatt des abstrakten Begriffs der Valenz jetzt der freie Platz auf dem Atomkernring antritt. Wenn der Atomkernring nicht ausreichend von Elektronen abgeschirmt ist, gibt es eine Möglichkeit (Valenz) der weiteren Bindung mit anderen Atomen oder Molekülen. Dieses kann man sehr anschaulich mit folgendem Beispiel schildern.
Die Valenz des Bors ist gleich 3. Die Valenz des Wasserstoffs ist gleich 1. Darum müßte die Verbindung Bortrihydrid BH3 oder Boran existieren. Es gibt aber nur das Diboran B2H6. Die Existenz des Diborans kann man zur Zeit so gut wie nicht erklären. Man ist so weit, daß man behauptet, daß das Wasserstoffatom mit seinem einzigen Elektron sich gleichzeitig mit zwei Boratomen verbinden kann. Nur das kann die Existenz des Diborans erklären. Aber kann man damit erklären, warum das Wasserstoffatom das tut? Warum verbindet es sich nicht immer mit zwei Atomen?
Damit alles paßt, ist man gezwungen anzunehmen, daß das Boratom mit seinen 3 Valenzelektronen sich mit vier H-Atomen verbinden kann. Behauptet man dabei nicht, daß in diesem Falle das Wasserstoffatom die Valenz 2, und das Boratom die Valenz vier hat? In allen anderen Fällen hat das Wasserstoffatom die Valenz 1, und das Boratom die Valenz 3. Auch in Diboran selbst haben 2 aus 3 H-Atomen die normale Valenz 1. Das Einverständnis, daß das Wasserstoffatom einmal die Valenz 1 und andermal die Valenz 2 hat, und dazu noch in einer und der gleichen Verbindung, ohne zu erklären, warum so etwas geschieht, kann man wahrscheinlich als Abkommen bezeichnen. Wenn man ehrlich sein will, muß man einfach gestehen, daß die Erklärung an die Haaren herangezogen ist. Anständiger wäre zu sagen, daß die Erklärung nach der existierender Definition der Valenz nicht immer funktioniert.
(Auf eine Frage, wie die Fernwirkung entsteht, antwortete Newton: „Ich erdenke keine Hypothesen“. Gemeint wurde: „Die ich nicht beweisen kann“. Sokratus antwortete oft: „Das weis man nicht“ oder auch „Das weis ich nicht“. Die heutige Professoren bevorzugen sich als allwissende darzustellen und genieren sich nicht eine unlogische Erklärung zu geben, die bei einem Studenten den Eindruck weckt, daß er etwas nicht verstehen kann. Eine ehrliche Antwort: „Das weis man nicht“ würde einen ehrgeizigen Studenten zur Suche nach einer vernünftigen Erklärung motivieren und er würde nicht denken, daß er minderwertig ist und die „kluge“ Erklärung des Professors nicht verstehen kann.)
Aufgrund des neuen Atommodells kann man die Existenz des Diborans leicht erklären und gleichzeitig auch verstehen, warum es das Boran nicht gibt. Und zwar ohne ein Abkommen mit eigener Ehrlichkeit zu treffen. Das Boran könnte so aussehen, wie es in der Abb. 5.1
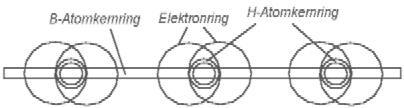
Abb. 5.1 Das Boran - BH3 enthält 3 H- Elemente auf der Außenseite seines Bor-Atomkernrings. Auf dem Bor-Atomkernrings gibt es noch viel freien Platz, infolge dessen bleibt dieses Molekül chemisch aktiv.
gezeigt ist: auf dem Atomkernring des Bors sind 3 seine Elektronenringe je mit einem H-Atom verbunden. Wenn aber der Radius des Atomkernrings des Bors nicht kleiner ist, als der des Kohlenstoffs, dann bleibt auf dem B-Atomkernring noch viel Platz. Die Möglichkeit zur weiteren Bindung ist, folglich, nicht gestillt. Man kann vermuten, daß ein Boran-Molekül sich mit einem anderen verbinden kann. Die Abb. 5.2 zeigt die Erfüllung dieser Möglichkeit. Die zwei B-Atomkernringe des Diboran-Moleküls sind mit Hilfe von zwei H--Elemente verbunden. Die anderen H--Elemente sind nur mit einem der B-Atomkernringe verbunden. Die Atomkernringe sind voll besetzt, das Diboran-Molekül ist ausreichend chemisch passiv. Darum ist es bei normalen Bedingungen ein Gas.
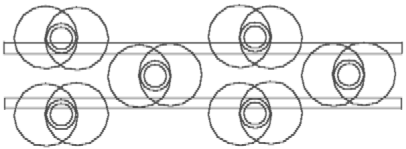
Abb. 5.2. Das Diboran-Molekül - B2H6. Die Atomkernringe sind voll besetzt, das Molekül ist ausreichend chemisch passiv.
Die Darstellung in der Abb. 5.2 folgt der existierender Vorstellung, daß im Diboran-Molekül zwei H-Atome zwei Boratome verbinden. Das Diboran kann man aber auch anders darstellen. Jedes Bor-Atomkernring hat 6 Plätze für Elektronenringe. Jedes Boratom hat 3 Valenzelektrone, also insgesamt 6. Wenn 6 H-Atome, die sich nach der Formel B2H6 mit zwei Boratomen verbinden, sich mit 6 Valenzelektronen der zwei Boratomen verbinden, dann haben wir genau 6 H--Elemente, die auf den zwei Bor-Atomkernringen Platz finden müssen. Wenn jedes von den 6 H--Elemente mit der freien Hälfte eines Elektronrings sich mit einem Bor-Atomkernring und mit der freien Hälfte des anderen Elektronrings sich mit dem anderen Bor-Atomkernring verbindet, dann bekommen wir das Bild, daß in der Abb. 5.3
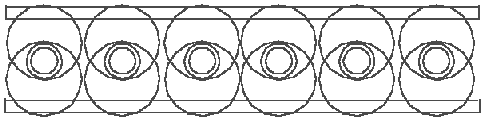
Abb. 5.3. Ein symmetrisches Molekül des Diborans.
gezeigt ist. Alle freie Plätze sind auf den Bor-Atomkernringen besetzt, die Boratome sind mit Hilfe der 6 H--Elemente fest miteinander verbunden. In dieser Bindung benimmt sich jedes H-Atom genau, wie alle anderen, ohne jede Ausnahme. Welche von diesen zwei Darstellungen des Diborans (Abb. 5.2 oder 5.3) richtig ist, oder welches mehr der Wirklichkeit entspricht, kann aus energetischen Gründen bestimmt werden. Der Schönheit und der Symmetrie halber, müssen wir den Vorzug der Abb. 5.3 geben.
Jetzt kann man noch mal eine Definition der Valenz geben, die äquivalent der schon gegebenen, aber vielleicht viel deutlicher ist. Wenn das (einzige) Elektron von dem H-Atomkern getrennt ist, das heißt, wenn das H-Atom ionisiert ist, dann haben wir die maximal mögliche Polarisation des Wasserstoffatoms, weil wir einen (+)Pol (den Atomkern) und weit weg von ihm den (-)Pol (das Elektron) haben. Diese maximale Polarisation bedeutet auch die maximal mögliche Bindungsenergie. Bei der Bindung des Elektrons mit dem Proton kann man 13,53 eV gewinnen. Energetisch gesehen, bedeutet die maximale Polarisation die maximale Möglichkeit der Energiegewinnung bei der Bindung, die die zwei polarisierte Elemente sozusagen “anstreben”. Ein Atom, von weit weg gesehen, ist nicht polarisiert, es ist elektrisch neutral. Wenn wir das Atom in der Nähe betrachten, können wir lokale elektrische Felder bemerken. Das H-Atom ist von der Sicht eines gewissen Abstands vom Atom, viel stärker polarisiert, als das He-Atom, weil es verhältnismäßig weit voneinander befindende Teile des positiven Atomkernrings und des negativen Elektronrings hat. Das H-Atom kann sich mit anderen Atomen binden, das He-Atom aber nicht.
Auch das Boran hat positive Teile des Bor-Atomkernrings, die sich verhältnismäßig weit von negativen Teilen der Elektronringen befinden. Und auch Boran kann sich weiter chemisch binden. Also kann man sagen, daß die Valenz (Möglichkeit) sich zu binden dann besteht, wenn eine ausreichend starke lokale Polarisation vorhanden ist. Aber eine lokale Polarisation besteht immer, auch beim He-Atom. Als erste Näherung kann man folgende Definition annehmen:
Die chemische Valenz sich zu binden besteht dann, wenn der Atomkern entlang seines Rings einen freien Platz hat oder haben kann, dessen Größe vergleichbar mit der Länge seines Radius ist.
Diese Definition gilt nur für Verbindungen von Atomen der ersten zwei Perioden der chemischen Elemente gültig. Die allgemeine Definition der Valenz kann so klingen: Wenn ein Atom oder Molekül ein ausreichend starkes Feld im Abstand von einem Elektronradius von seinen Bestandteilen hat, dann besitzt es die Möglichkeit zur chemischen Bindung. In dieser Definition, damit sie ganz genau wäre, fehlt nur noch die Angabe der Stärke des Feldes. Es ist auch klar, daß, damit eine Bindung entstehen kann, müssen beide Bindungspartner dieser Definition entsprechen.
Diese Definition zeigt aber, daß die Möglichkeit zur Bindung zwischen Atomen immer besteht, auch wenn es nur eine schwache Bindung sein wird. Zwischen ihnen gibt es keinen qualitativen, sondern nur einen quantitativen Unterschied. Die schwache Möglichkeit zur Bindung kommt zur Verwirklichung beim Verflüssigen der Gase oder beim Gefrieren der Flüssigkeiten. Außerdem zeigt diese Definition, daß man, rein theoretisch gesehen, keine scharfe energetische Grenze zwischen den starken chemischen Bindungen und den schwächeren physikalischen Bindungen (z.B., der Verflüssigung) ziehen kann. Dies beweist die Bindung zwischen Wassermolekülen im Wasser, die so stark ist, daß man sie durchaus mit der Stärke der chemischen Bindungen vergleichen kann.
Die Beispiele zeigen, daß alle Wasserstoffatome überall das gleiche tun - sie verbinden sich mit einem Elektron, bilden damit das Element H- und nachdem, abhängig davon, ob es Platz gibt, verbinden die H-- Elemente zwei Atomkernringe oder befinden sich in der Nähe nur des einen.
6. Symmetrie und Asymmetrie einiger Molekülen
Die Strukturformel des Benzols ist nach dem Begriff der formalen Valenz asymmetrisch. Sie stellt einen Ring aus 6 Kohlenstoffatomen dar, die mit Hilfe ihrer Elektronen miteinander gebunden sind. Weil Kohlenstoff die Valenz 4 hat, kann er sich vier mal mit anderen Atomen binden: zweimal mit einem C-Atom-Nachbar, einmal mit dem anderen C-Atom-Nachbar und einmal mit dem H-Atom. Die Asymmetrie besteht in dem, daß er einmal mit einem C-Atom-Nachbar, zwei mal mit dem anderen C-Atom-Nachbar sich bindet. Nach den existierenden Regeln geht es nicht anders.
Das „schlimme“ ist, daß die Forscher die einfache Bindung von der zweifachen unterscheiden können. Nach ihren Ergebnissen sind beide Bindungen des C-Atoms in dem Benzol-Ring mit seinen C-Atom-Nachbarn gleich lang. Und das muß erklärt werden. Dies wurde mit Hilfe der Resonanzmethode gemacht. Die einfache Bindung wirkt (wie?!) auf die doppelte und umgekehrt (!). Der Mechanismus dieser “Wechselwirkung” ist sehr einfach. Es werden nebeneinander zwei Strukturformeln der Benzol-Ringe niedergeschrieben, in einer werden die doppelten Bindungen anstelle der einfachen Bindungen und umgekehrt dargestellt. Die zwei Strukturformeln(!) wechselwirken jetzt angeblich miteinander - und die Bindungen werden infolge gleichlang (!!!).
Wer nicht glaubt, daß man so einen Unsinn niederschreiben kann, kann es nachlesen in [7 ] oder in vielen anderen Lehrbüchern der Chemie. Mit Hilfe des Wörtchen “Resonanz” wird aus Asymmetrie Symmetrie gemacht. Wie eine Bindung und aus welchem Grunde auf die andere wirken kann, wie das niederschreiben nebeneinander von zwei Formeln (die nur in unserem Gehirn, oder, besser gesagt, nur auf Papier existieren!) eine Resonanz hervorrufen kann, wird nicht erklärt. Es wird nur behauptet. So kommt zum Tragen die Kraft der Wörter. Soll das nicht rein zufällig eine kabbalistische Methode sein?!
Eine ehrliche Erklärung: “Die beiden Bindungen zwischen den C-Atomen im Benzolring sind gleichlang, wir wissen aber nicht warum”, - würde die Suche nach einer Erklärung fördern. Die kabbalistische Erklärung mit Hilfe der Resonanzmethode fördert nichts, läßt uns aber scheinbar allwissend zu sein, wir heben uns von der Masse ab, die verstehen muß: “Ich habe es ja Ihnen erklärt, aber Sie werden es doch nicht und nie begreifen. Wenn Sie aber klug genug sind, können Sie es einfach wiederholen, und dann werden andere denken, daß auch Sie es begriffen haben”. Immer, wenn wir etwas nicht wissen, kommt uns die Mystik zur Hilfe.
Es versteht sich, daß viele klug genug waren. Die Resonanzmethode ist in der Chemie sehr populär geworden. Fast alles, was unverständlich zu sein scheint, kann man mit ihrer Hilfe erklären. Man muß nur verschiedene Schreibweisen der gleichen Formel finden - und schon können sie in Wechselwirkung treten mit folgender Resonanz. Auf Papier ist alles möglich. Papier hat eben Geduld.
Die neuen Atommodelle erlauben den Benzolring symmetrisch in einer einzigen Darstellung zu zeigen. In der Abb. 6.1 ist zwischen den Linien AB und CD ein Sechstel des Benzolrings dargestellt. Die Kohlenstoff-Atomkernringe sind mit Hilfe der H- -Elemente miteinander verbunden - von beiden Seiten gleich, also symmetrisch. Sie besetzen auf dem C-Atomkernring je 1,5 Elektronenplätze, genau wie im Falle des Methans (Abb. 3.5), nur unter anderem Winkel zum Atomkernring. Weil jedes C-Atom mit zwei anderen verbunden ist, befinden sich H--Elemente von beiden Seiten des C-Atomkernrings. Sie besetzen also auf jedem C-Atomkernring 3 Elektronenplätze. Jeder C-Atomkernring hat 6 Elektronenplätze und 4 Valenzelektronen. Eins von den 4 Valenzelektronen bildet mit einem H-Atom das H- - Element von einer Seite des C-Atomkernrings, es verbleiben von jedem C-Atom noch 3 Elektronen für 3 freie Plätze. Das bedeutet, das zwischen den zwei H--Elementen von einer
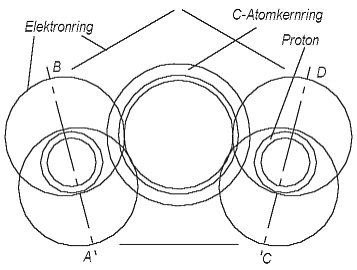
Abb. 6.1. Ein Sechstel des
Benzolrings (zwischen den Geraden AB und CD).Seite des C-Atomkernrings sich ein Elektronring befindet (in der Abb. 6.1 unten in der Mitte), und von der anderen Seite (oben) die andere zwei Elektronringe. Aus diesem folgt, daß die Symmetrieachsen AB und CD der zwei H--Elemente nicht parallel zueinander sind, sie bilden in der Blattebene einen Winkel. Das, was sich zwischen den Symmetrieachsen AB und CD in der Abb. 6.1 befindet - ist genau ein sechstel des Benzolrings, und weil ein Ring auf der Ebene immer 360o enthält, müßte auch der Winkel zwischen den Symmetrieachsen AB und CD gleich 60o sein. Er ist aber viel kleiner. Wenn wir die Zeichnung zwischen den Symmetrieachsen AB und CD 6 mal wiederholen und dann entlang der Achsen sie zusammenlegen, bekommen wir nicht einen Ring, sondern nur einen Teilring. Wir wissen aber, daß wenn wir einen Teilring aus Papier ausschneiden und die Ränder zusammenlegen, dann bekommen wir doch einen Ring, aber einen konischen. Der Benzolring wird in unserer Darstellung kein flacher Ring, sonder ein konischer, ein dreidimensionaler sein.
Resümee.
Die Darstellung der Elektronen und Atomkerne in Form von Ringen erlaubt eine nichtformale Definition der Valenz (Möglichkeit zur chemischen Bindung) zu geben, die als freier Platz zum „anlegen“ eines Teils der Elektronenringen oder als Vorhandensein einer ausreichend großer Polarisationszone des Atoms bezeichnet werden kann. Die neuen Atommodelle erlauben eine neue einfache Erklärung der Existenz des Diborans und umgekehrt der Nichtexistenz des Borans zu geben. Sie erlauben die Symmetrie der Moleküle wie Benzol ohne der Verwendung der kabbalistischen „Resonanzmethode“ zu erklären und vieles mehr.
Anmerkung. Man möchte erinnern, daß nach der Veröffentlichung des Atommodells von Nils Bohr man 12 Jahre lang kein einziges Molekül darstellen konnte. Das neue Modell erlaubt vom Anfang an praktisch jedes einfache Molekül darzustellen. Der Autor meint, daß das neue Atommodell eine viel bessere Annäherung an die Wirklichkeit sein wird, als das zur Zeit anerkannte Modell, aber es ist immer noch nicht die Wirklichkeit selbst. Wenn jemand einen Fall findet, in dem das neue Modell nach seiner Meinung nicht angewendet werden kann, bittet der Autor um eine Mitteilung.
Literatur:
1. J. Kern, Pritschinno-sledstwennoe tolkowanie islutschenija fotonow i spektra islutschenija gasow, Rodina, Nr. 11(38), 2001,
|
|